题目内容
20.用单线桥法标出下列反应的电子转移的方向和数目过量铁粉与稀硝酸反应的方程式为:3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O该反应的氧化剂是HNO3,还原产物是NO.分析 3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O中,Fe元素的化合价由0升高为+2价,硝酸中N元素的化合价由+5价降低为+2价,以此来解答.
解答 解:N元素的化合价降低,则HNO3为氧化剂,还原产物为NO,Fe元素的化合价由0升高为+2价,硝酸中N元素的化合价由+5价降低为+2价,该反应中3molFe反应生成6mol电子,则电子转移方向和数目为 ,
,
故答案为: ; HNO3;NO.
; HNO3;NO.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移的表示方法,题目难度不大.

练习册系列答案
相关题目
10.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,5.8g丁烷分子所含的共价键数目为1.4NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下11.2L四氯甲烷所含分子数为0.5NA | |
| D. | 乙烯、丙烯、丁烯的混合气体共28g,其所含的原子总数为6NA |
15.检验烧碱中是否混有纯碱的方法是( )
| A. | 灼烧,看火焰是否为黄色 | B. | 滴加盐酸,看是否有气体产生 | ||
| C. | 溶解后测定溶液是否为碱性 | D. | 加热,看是否有气体生成 |
5. 如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 正反应是吸热反应 | B. | 若A、B是气体,则D是液体或固体 | ||
| C. | 改变物质浓度,平衡不会移动 | D. | A、B、C、D均为气体 |
12.下列有关表述正确的是( )
(1)-OH与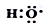 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
(2)次氛酸的电子式为:
(3)Mg2+的离子结构示意图:
(4)CO2的球棍模型示意图:
(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4.
(1)-OH与
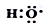 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同(2)次氛酸的电子式为:

(3)Mg2+的离子结构示意图:

(4)CO2的球棍模型示意图:

(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4.
| A. | (1)(2) | B. | (3)(5) | C. | (4)(5) | D. | (1)(5) |
9.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 等物质的量的甲烷和一氧化碳所含的分子数前者大于后者 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 相同条件下的一氧化碳和氮气,若气体体积相等,则质量也相等 |
 (1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.
(1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”.你知道其中的奥妙吗?请用化学方程式表示其反应原理Fe+CuSO4=Cu+FeSO4 .若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出正负极电极反应式.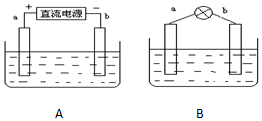 采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问:
采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问: