题目内容
17.某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中c(NH4+)随反应进行逐渐减小.下列判断错误的是( )| A. | 反应的氧化剂是ClO- | |
| B. | 反应生成l mol氧化产物时,转移的电子为6 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
分析 根据c(NH4+)随反应进行逐渐减小,故NH4+应是反应物,N2是生成物N元素化合价发生变化,具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,以此解答该题.
解答 解:方程式为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,
A.具有氧化性的ClO-为反应物,充当氧化剂,故A正确;
B.N元素化合价由-3价升高到0价,则N2为氧化产物,所以生成l mol氧化产物,转移2×(3-0)=6mol电子,故B正确;
C.由方程式可知氧化剂和还原剂的物质的量之比为3:2,故C错误;
D.由反应3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,生成了氯离子和氢离子,所以反应后溶液的酸性明显增强,故D正确;
故选C.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
5. 如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 正反应是吸热反应 | B. | 若A、B是气体,则D是液体或固体 | ||
| C. | 改变物质浓度,平衡不会移动 | D. | A、B、C、D均为气体 |
12.下列有关表述正确的是( )
(1)-OH与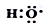 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
(2)次氛酸的电子式为:
(3)Mg2+的离子结构示意图:
(4)CO2的球棍模型示意图:
(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4.
(1)-OH与
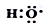 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同(2)次氛酸的电子式为:

(3)Mg2+的离子结构示意图:

(4)CO2的球棍模型示意图:

(5)熔化时NaHSO4的电离方程式为NaHSO4=Na++HSO4.
| A. | (1)(2) | B. | (3)(5) | C. | (4)(5) | D. | (1)(5) |
9.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 等物质的量的甲烷和一氧化碳所含的分子数前者大于后者 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 相同条件下的一氧化碳和氮气,若气体体积相等,则质量也相等 |
6.下列有关说法不正确的是( )
| A. | 胶体的丁达尔效应与微粒直径大小有关 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作水的消毒剂 | |
| C. | 可用半透膜除去淀粉溶液中的少量NaCl | |
| D. | 向饱和氯化钠溶液中加入一小块钠,恢复原温度后溶液中有固体析出 |
7.下列数据不一定随着温度升高而增大的是( )
| A. | 化学反应速率v | B. | 化学平衡常数K | ||
| C. | 弱电解质的电离平衡常数K | D. | 水的离子积常数Kw |
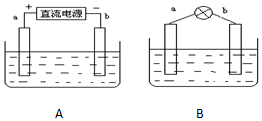 采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问:
采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问: Fe(SCN)3.
Fe(SCN)3.