题目内容
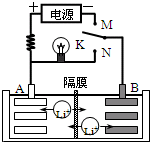
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水.当K闭合时,X电极附近溶液先变红.下列分析不正确的是( )


| A、A的金属活动性强于B |
| B、Y的电极反应:2Cl--2e-═Cl2↑ |
| C、阴离子交换膜处的SO42-从左向右移动 |
| D、当电路中有0.1mol电子通过时B电极有0.05mol金属析出 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置中右边装置不能自发的进行氧化还原反应是不能构成原电池只能形成电解池,左边装置中能发生的进行氧化还原反应且符合原电池的构成条件所以是原电池.当K闭合时,X电极附近溶液先变红,说明X极生成OH-,为电解氯化钠溶液的电解装置,说明A为负极,B为正极,即A的金属活动性大于B;连接B的y极为Y阳极,连接A的x极为阴极,以此解答该题.
解答:
解:A.当K闭合时,X电极附近溶液先变红,说明X极生成OH-,说明A为负极,B为正极,即A的金属活动性大于B,故A正确;
B.Y为阳极,发生氧化反应,电极方程式为2Cl--2e-═Cl2↑,故B正确;
C.原电池中,阴离子向负极移动,应从B移向A,故C错误;
D.B化合价为+2价,当电路中有0.1mol电子通过时B电极有0.05mol金属析出,故D正确.
故选C.
B.Y为阳极,发生氧化反应,电极方程式为2Cl--2e-═Cl2↑,故B正确;
C.原电池中,阴离子向负极移动,应从B移向A,故C错误;
D.B化合价为+2价,当电路中有0.1mol电子通过时B电极有0.05mol金属析出,故D正确.
故选C.
点评:本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力能力的考查,难度较大,明确原电池放电时溶液中颜色的变化是解本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、流水、风力是一次能源,电力、蒸汽是二次能源 |
| B、普通锌锰电池是一次电池,碱性锌锰电池是二次电池 |
| C、同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
| D、原子核外电子层数越多,原子半径一定越大 |
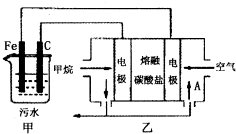 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 |
| B、甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C、为了增加污水的导电能力,应向污水中如入适量的H2SO4溶液 |
| D、当乙装置中有1.6g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48L |
 如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:负极:LixC6-xe-═C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-═LiMnO2(LiMnO2表示含锂原子的MnO2)
下列有关说法正确的是( )
A、该电池的反应式为Li1-xMnO2+LixC6
| |||
| B、K与M相接时,A是阳极,发生氧化反应 | |||
| C、K与N相接时,Li+由A极区迁移到B极区 | |||
| D、在整个充电或放电过程中都只存在一种形式的能量转化 |
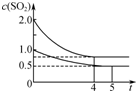 向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.
向甲、乙两个容积均为1L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2mol SO2、1mol O2,乙充入1mol SO2、0.5mol O2),发生反应:2SO2(g)+O2(g)?2SO3(g);△H=-197.74kJ?mol-1.一段时间后达到平衡,测得两容器中c(SO2)(mol?L-1)随时间t(min)的变化关系如图所示.下列说法正确的是( )
| A、热量:Q(甲)<2Q(乙) |
| B、压强:p(甲)<2p(乙) |
| C、乙中前5 min内的反应速率v(O2)=0.10 mol?L-1?min-1 |
| D、保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2 mol O2、0.4 mol SO3,则此时v(正)<v(逆) |
下列各项性质,属于C2H6、C2H4、C2H2共性的是( )
| A、常温常压下是无色无味气体 |
| B、在通常状况下,密度比空气小 |
| C、能使酸性KMnO4溶液褪色 |
| D、在一定条件下能发生加聚反应 |
下列说法正确的是:①植物油和裂化汽油都可以使溴水褪色;②糖类、油脂和蛋白质都能发生水解反应;③蛋白质溶液中加入浓的硫酸铵溶液会有沉淀析出;④防腐剂福尔马林可用作食品保鲜剂;⑤乙醇、乙酸、乙酸乙酯都能发生取代反应;⑥汽油、甘油和花生油都是混合物,无固定的沸点,只有花生油能与氢氧化钠溶液反应( )
| A、①③⑤ | B、①②⑤ |
| C、②④⑥ | D、②③⑥ |
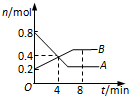 某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.下列说法不正确的是( )
某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.下列说法不正确的是( )| A、该反应的化学方程式为:2A→B |
| B、反应开始至4 min时,A的平均反应速率为0.05 mol/(L?min) |
| C、4 min时,正、逆反应速率的大小关系为:v(正)>v(逆) |
| D、8 min时,正、逆反应速率的大小关系为:v(正)<v(逆) |
下列说法正确的是( )
| A、向氨水中加水稀释后,溶液中除了H2O以外其他粒子浓度都下降 |
| B、若NaHC2O4溶液的pH=5,则溶液中c(C2O42-)<c(H2C2O4) |
| C、pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液体积的m倍和n倍,若稀释后两溶液的pH仍相同,则m<n |
| D、室温下,pH=4的氯化铵溶液与pH=4的稀盐酸中,由水电离出的c(H+)之比为106:1 |