题目内容
5.下列各组物质只用一种试剂就可以鉴别的是( )| A. | 甲烷、乙炔、乙烯、丙烯 | B. | 苯、甲苯、己烷 | ||
| C. | CH3CHO、CH3COOH、CH3CH2OH | D. | C6H5OH、C6H5C2H5、C6H6 |
分析 A.乙炔、乙烯、丙烯均含不饱和键;
B.苯、甲苯、己烷均不溶于水,密度均比水小;
C.利用氢氧化铜可鉴别;
D.C6H5C2H5、C6H6均不溶于水,密度均比水小.
解答 解:A.乙炔、乙烯、丙烯均含不饱和键,则一种试剂不能鉴别,故A不选;
B.苯、甲苯、己烷均不溶于水,密度均比水小,则一种试剂不能鉴别,故B不选;
C.分别氢氧化铜混合的现象为:砖红色沉淀、蓝色溶液、无现象,现象不同可鉴别,故C选;
D.C6H5C2H5、C6H6均不溶于水,密度均比水小,则一种试剂不能鉴别,故D不选;
故选C.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的性质、性质差异及发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
15.下列四种有机化合物均含有多个官能团,其结构简式如图所示,下面有关说法中正确的是( )


| A. | A属于酚类,可与NaHCO3溶液反应产生CO2 | |
| B. | B属于酚类,能使FeCl3溶液显紫色 | |
| C. | 1 mol C最多能与1 mol Br2发生苯环上取代反应 | |
| D. | D属于醇类,可以发生消去反应 |
16.对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答):
(1)其中原子半径最小的是H元素,没有正化合价的是O、F元素.
(2)其中非金属元素有8种,非金属性最强的是F元素.
(3)其中气态氢化物溶于水呈碱性的是N元素,其气态氢化物的化学式是NH3.
(4)其中最高价氧化物对应水化物碱性最强的是Na元素,其最高价氧化物对应水物化学式是NaOH,其最高价氧化物对应化物含有的化学键类型是离子键和共价键.
(5)⑩号元素最高正价含氧酸只具有共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)其中非金属元素有8种,非金属性最强的是F元素.
(3)其中气态氢化物溶于水呈碱性的是N元素,其气态氢化物的化学式是NH3.
(4)其中最高价氧化物对应水化物碱性最强的是Na元素,其最高价氧化物对应水物化学式是NaOH,其最高价氧化物对应化物含有的化学键类型是离子键和共价键.
(5)⑩号元素最高正价含氧酸只具有共价键.
13.已知:(1)Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s);△H=-348.3kJ•mol-1
(2)2Ag(s)+$\frac{1}{2}$O2(g)=Ag2O(s);△H=-31.0kJ•mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
(2)2Ag(s)+$\frac{1}{2}$O2(g)=Ag2O(s);△H=-31.0kJ•mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
| A. | -317.3 kJ•mol-1 | B. | -379.3 kJ•mol-1 | C. | +317.3 kJ•mol-1 | D. | +379.3 kJ•mol-1 |




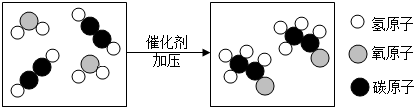
 )中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.
)中六元钚结构与苯环类似,它与硝基苯的相对分子质量之差为3,其熔点为354℃,硝基苯的熔点是5.7℃.