题目内容
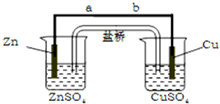
1.下列实验装置,其中按要求设计正确的是( )| A. |  电解饱和食盐水 | B. |  铜锌原电池 | ||
| C. |  电镀银 | D. |  电解精炼铜 |
分析 A.用Fe作阳极电解饱和食盐水时,阳极上Fe失电子生成Fe2+;
B.含有盐桥的原电池中,电极材料与其对应的盐具有相同的金属元素;
C.电镀时,镀层作阳极、镀件作阴极,且阳极材料与电解质溶液中金属元素为相同金属元素;
D.电解精炼粗铜时,粗铜作阳极、纯铜作阴极.
解答 解:A.用Fe作阳极电解饱和食盐水时,阳极上Fe失电子生成Fe2+,阳极反应式为Fe-2e-=Fe2+,所以阳极上没有氯气生成,淀粉碘化钾溶液也不变蓝色,故A错误;
B.含有盐桥的原电池中,电极材料与其对应的盐具有相同的金属元素,Zn和硫酸锌、Cu和硫酸铜都分别具有相同金属元素,所以能构成原电池,故B正确;
C.电镀时,镀层作阳极、镀件作阴极,阳极材料与电解质溶液中金属元素为相同金属元素,则在钥匙上镀Ag,Ag作阳极、钥匙作阴极,要用硝酸银作电解质,故C错误;
D.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,所以故D错误;
故选B.
点评 本题考查原电池和电解池原理,为高频考点,明确各个电极上发生的反应是解本题关键,电解精炼粗铜、电镀都属于电解,易错选项是A,注意:较活泼金属作阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,题目难度不大.

练习册系列答案
相关题目
12.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 11.2 g Fe投入到400 mL 1 mol/L的硝酸中充分反应,转移电子总数为0.2 NA | |
| B. | 标准状况下,11.2 L C2H6含3 NA个C-H极性共价键 | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
16.下列离子方程式正确的是( )
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | SO2通入碘水中,反应的离子方程式为:SO2+I2+2H2O═SO32-+2I-+4H+ |
6.下列有关物质的保存方法,不正确的是( )
| A. | 液氯储存在钢瓶中 | B. | 新制氯水保存在黑色广口瓶中 | ||
| C. | 少量金属钠保存在煤油中 | D. | 氯化亚铁溶液加入少量的铁粉保存 |
11.化学与生产、生活、社会密切相关.下列说法正确的是( )
| A. | SO2具有还原性,可用于蔗糖脱色 | |
| B. | 双氧水具有强氧化性,可用于杀菌消毒 | |
| C. | 铁粉表面积大,可用作食品干燥剂 | |
| D. | SiO2具有导电性,可用于制造光导纤维 |
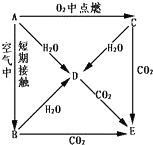 A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.