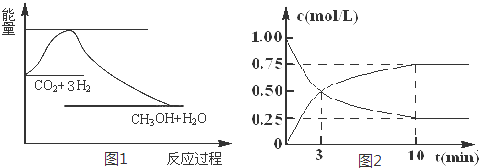
题目内容
6.下列有关物质的保存方法,不正确的是( )| A. | 液氯储存在钢瓶中 | B. | 新制氯水保存在黑色广口瓶中 | ||
| C. | 少量金属钠保存在煤油中 | D. | 氯化亚铁溶液加入少量的铁粉保存 |
分析 A.干燥的氯气和钢不反应;
B.液体一般保存在细口瓶中;
C.钠的性质活泼,在空气中易氧化;
D.硫酸亚铁易被氧化为硫酸铁.
解答 解:A.干燥的氯气和钢不反应,可储存在钢瓶中,故A正确;
B.新制氯水保存在黑色细口瓶中,故B错误;
C.钠化学性质活泼,应该隔绝空气密封保存,少量钠可以保存在煤油中,大量钠可以密封在石蜡中,故C正确;
D.硫酸亚铁易被氧化为硫酸铁,常加入少量铁粉防止亚铁离子被氧化,故D正确.
故选B.
点评 本题考查了常见试剂的保存方法,本题难度不大,试题培养了学生灵活应用所学知识的能力.注意掌握常见化学试剂的性质及正确保存方法,液体一般保存在细口瓶中,固体保存在广口瓶中.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
16.关于如图所示原电池的说法正确的是( )
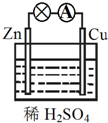

| A. | Zn为正极,Cu为负极 | B. | 该装置将化学能转变为电能 | ||
| C. | 正极反应式为Cu-2e-═Cu2+ | D. | 电子由铜片通过导线流向锌片 |
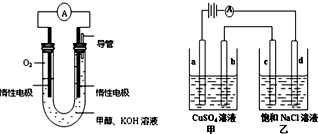
1.下列实验装置,其中按要求设计正确的是( )
| A. |  电解饱和食盐水 | B. |  铜锌原电池 | ||
| C. |  电镀银 | D. |  电解精炼铜 |
11.根据反应2Fe3++2I-?2Fe2++I2设计原电池如下图所示,判断下列说法正确的是( )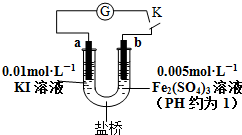

| A. | 电流计G指针指向零时,说明U形管中反应达到平衡状态 | |
| B. | 当电路中电流为零时,增加KI溶液的浓度,则a极为正极 | |
| C. | 当U形管b端颜色逐渐加深时,说明b极为负极 | |
| D. | 盐桥中阳离子一定向右移动 |
15.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与H2O反应,转移的电子总数为0.1NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
16.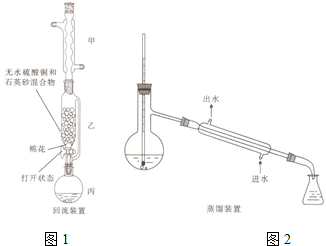 苯甲酸(
苯甲酸(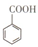 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:
实验方案为:
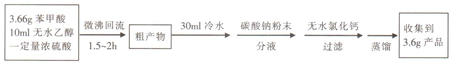
(1)仪器甲的名称为球形冷凝管.
(2)①往丙中加入药品的顺序为C.
A.无水乙醇、浓硫酸、苯甲酸晶体 B.浓硫酸、苯甲酸晶体、无水乙醇
C.苯甲酸晶体、无水乙醇、浓硫酸 D.苯甲酸晶体、浓硫酸、无水乙醇
②若加热反应后发现未加沸石,应采取的正确操作是停止加热,冷却后再加入沸石.
③微沸回流过程中,可以看到乙内的混合试剂的颜色变为蓝色.
(3)加入碳酸钠粉末的作用是中和浓硫酸及未反应的苯甲酸.
(4)分液要用到的玻璃仪器有分液漏斗、烧杯,粗产物在下层(填“上”或“下”).
(5)加热蒸馏若采用2图装置(加热装置已经略去)进行,该装置存在的2个问题为温度计的水银球不应插入反应液中、不应用直型冷凝管.
(6)本实验所得到的苯甲酸乙酯产率为80%.
(7)装置乙的作用为乙中的吸水剂可以吸收反应中产生的水分,有利于提高酯的产率.
 苯甲酸(
苯甲酸( )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶 |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 苯甲酸乙酯 | 150 | 1.05 | 212.6 | 难溶 |

(1)仪器甲的名称为球形冷凝管.
(2)①往丙中加入药品的顺序为C.
A.无水乙醇、浓硫酸、苯甲酸晶体 B.浓硫酸、苯甲酸晶体、无水乙醇
C.苯甲酸晶体、无水乙醇、浓硫酸 D.苯甲酸晶体、浓硫酸、无水乙醇
②若加热反应后发现未加沸石,应采取的正确操作是停止加热,冷却后再加入沸石.
③微沸回流过程中,可以看到乙内的混合试剂的颜色变为蓝色.
(3)加入碳酸钠粉末的作用是中和浓硫酸及未反应的苯甲酸.
(4)分液要用到的玻璃仪器有分液漏斗、烧杯,粗产物在下层(填“上”或“下”).
(5)加热蒸馏若采用2图装置(加热装置已经略去)进行,该装置存在的2个问题为温度计的水银球不应插入反应液中、不应用直型冷凝管.
(6)本实验所得到的苯甲酸乙酯产率为80%.
(7)装置乙的作用为乙中的吸水剂可以吸收反应中产生的水分,有利于提高酯的产率.
 (1)CH3OH是一种可燃性的液体.
(1)CH3OH是一种可燃性的液体.