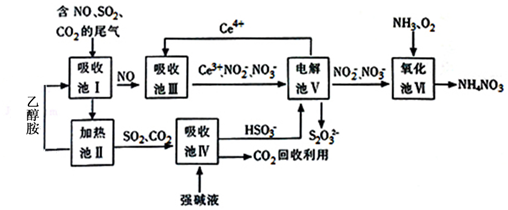
题目内容
10.实验室用KClO3和浓盐酸反应也可以制备氯气.某研究性学习小组利用如图所示装置在实验室中制取Cl2并探究其相关性质: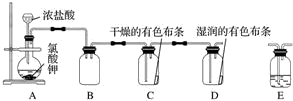
(1)装置A中存在两处错误,请改正这两处错误:改长颈漏斗为分液漏斗.
(2)写出装置A中发生反应的化学方程式:KClO3+6HCl=KCl+3Cl2↑+3H2O.
(3)为了除去氯气中的氯化氢,需要在装置A、B之间添加装置E,装置E中所盛装的试剂为饱和食盐水.为了探究使有色布条褪色的是氯气还 是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,装置E在整套装置中的添加位置为b(填字母).
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
(4)取下集气瓶B,将铁丝加热至红热状态,伸入其中,发生的相关反应的化学方程式是2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,能检验该反应产物中铁元素价态的试剂是d(填字母).
a.氯水 b.蒸馏水和铁粉 c.氢氧化钠溶液 d.KSCN溶液
(5)另外一个化学学习小组就环境保护方面指出了上述装置的缺陷,并给出了改进措施,该改进措施是在装置D后增加一个盛装碱液的装置,用碱液吸收剩余的氯气.
分析 (1)长颈漏斗不能控制液体的加入量,且浓盐酸易挥发,所以应选择分液漏斗;
(2)氯酸钾具有强的氧化性能够氧化氯化氢生成氯气;
(3)氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,据此选择除去氯化氢的试剂;装置C、D证明干燥的氯气不具有漂白性,潮湿的氯气具有漂白性,但要保障通入装置C的氯气必须为干燥氯气,所以装置C前需连上盛有浓硫酸的洗气瓶;
(4)铁丝在氯气中剧烈燃烧,生成氯化铁;三价铁离子遇到硫氰酸根离子显红色;
(5)氯气有毒直接排放会引起空气污染,应用氢氧化钠溶液吸收.
解答 解:(1)装置A中改长颈漏斗为分液漏斗,分液漏斗便于控制反应的进行,可以减少氯化氢的挥发;
故答案为:改长颈漏斗为分液漏斗;
(2)氯酸钾具有强的氧化性能够氧化氯化氢生成氯气,反应方程式:KClO3+6HCl=KCl+3Cl2↑+3H2O;
故答案为:KClO3+6HCl=KCl+3Cl2↑+3H2O;
(3)氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以为了除去氯气中的氯化氢,需要在装置A、B之间添加装置E,装置E中所盛装的试剂为饱和食盐水;
装置C、D证明干燥的氯气不具有漂白性,潮湿的氯气具有漂白性,但要保障通入装置C的氯气必须为干燥氯气,所以装置C前需连上盛有浓硫酸的洗气瓶,故选;
故答案为:饱和食盐水;b;
(4)铁与氯气反应生成氯化铁,方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;三价铁离子遇到硫氰酸根离子显红色,所以可以用硫氰酸钾溶液检验三价铁离子的存在;
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;d;
(5)氯气有毒直接排放会引起空气污染,应用氢氧化钠溶液吸收,所以在装置D后增加一个盛装碱液的装置,用碱液吸收剩余的氯气;
故答案为:在装置D后增加一个盛装碱液的装置,用碱液吸收剩余的氯气.
点评 本题考查了氯气的制备和性质检验,熟悉氯气制备原理及氯气的化学性质是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案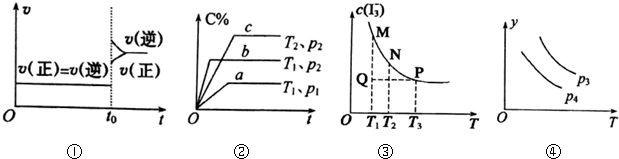
| A. | 图①对于达到平衡状态的N2(g)+3H2(g)?2NH3(g),在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 图②p2<p1,T1<T2 | |
| C. | 图③是反应:I2(aq)+I-(aq)?I3-(aq)的平衡体系中,I3-的物质的量浓度与温度(T)的关系图(曲线上的任何一点都代表平衡状态):Q点时,v正>v逆 | |
| D. | 图④对于反应2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Z的百分含量 |
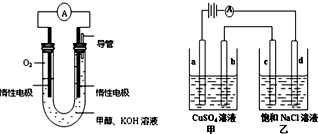
| A. |  电解饱和食盐水 | B. |  铜锌原电池 | ||
| C. |  电镀银 | D. |  电解精炼铜 |
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与H2O反应,转移的电子总数为0.1NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
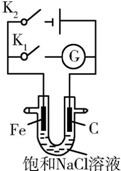
| A. | K1闭合,铁棒上发生的反应为2H++2e-═H2↑ | |
| B. | K1闭合,石墨棒周围溶液的pH逐渐降低 | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002NA个电子时,两极共产生0.002 mol气体 |
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 28g N2和N4组成的混合气体中含有的原子数为2 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
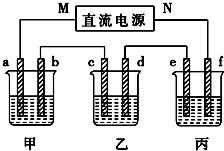 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: