题目内容
下列有关表述正确的是( )
| A、-OH与OH-组成元素相同,含有的质子数也相同 |
B、NH4Cl的电子式为: |
C、丙烷分子的比例模型示意图: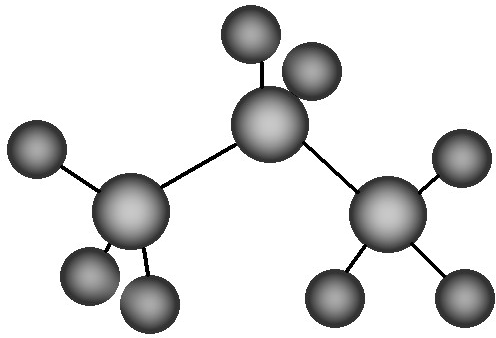 |
D、CO2分子的比例模型示意图: |
考点:球棍模型与比例模型,电子式
专题:化学用语专题
分析:A、质子数与组成元素的种类和各元素原子的个数有关,与核外电子数的得失无关;
B、NH4Cl为离子化合物,铵根离子中N与H是以共价键结合的;
C、此图为球棍模型而非比例模型;
D、二氧化碳中心原子为C采取sp杂化,故为直线型结构.
B、NH4Cl为离子化合物,铵根离子中N与H是以共价键结合的;
C、此图为球棍模型而非比例模型;
D、二氧化碳中心原子为C采取sp杂化,故为直线型结构.
解答:
解:A、-OH与OH-都是由氢、氧两种元素构成,由于含有的原子个数也相同,故质子数也相同,二者的区别在于OH-比-OH多一个电子,故A正确;
B、NH4Cl是由铵根离子和氯离子构成为离子化合物,铵根离子和氯离子为离子键,铵根离子中N与H是以共价键结合,故B正确;
C、此图中即能表示原子大小又能表现键长键角,因此为球棍模型而非比例模型,丙烷的比例模型为: ,故C错误;
,故C错误;
D、二氧化碳的分子构型为直线形, ,故D错误;
,故D错误;
故选:AB.
B、NH4Cl是由铵根离子和氯离子构成为离子化合物,铵根离子和氯离子为离子键,铵根离子中N与H是以共价键结合,故B正确;
C、此图中即能表示原子大小又能表现键长键角,因此为球棍模型而非比例模型,丙烷的比例模型为:
 ,故C错误;
,故C错误;D、二氧化碳的分子构型为直线形,
 ,故D错误;
,故D错误;故选:AB.
点评:本题考查的内容十分基础,注意比例模型和球棍模型的区别,书写离子化何物和共价化合物电子式的区别是解题关键.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 下列反应前后物质的总能量变化可用如图表示的是( )
下列反应前后物质的总能量变化可用如图表示的是( )| A、H-F═H+F |
| B、生石灰加水生成熟石灰 |
| C、金属钠与水反应 |
| D、HNO3+NaOH=NaNO3+H2O |
下列各组离子在溶液中能大量共存的是( )
| A、H+、C1-、CO32-、K+ |
| B、NH4+、OH-、Cl-、Na+ |
| C、Na+、NO3-、C1-、K+ |
| D、Ag+、NO3-、Cl-、K+ |
常温时,将V1mLc1mol?L-1的氨水滴加到V2mLc2mol?L-1的盐酸中,下述结论一定正确的是( )
| A、若V1≥V2,c1=c2,则混合液的pH>7 |
| B、若混合溶液的pH=7,则c1V1<c2V2 |
| C、若c1=c2,混合液中c(NH4+)═c(Cl-),则V1>V2 |
| D、若混合溶液的pH>7,则混合液中c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
0.5mol C2H4与Cl2完全加成,再与Cl2彻底取代,两过程共用Cl2( )
| A、1mol | B、2mol |
| C、2.5mol | D、3mol |
 如图所示,在容器A、B中分别装有20℃的水50mL,试管C、D相连通,其中存在下列平衡:2NO2(g)?N2O4(g)△H=-57kJ/mol;当向A中加入2g苛性钠时:
如图所示,在容器A、B中分别装有20℃的水50mL,试管C、D相连通,其中存在下列平衡:2NO2(g)?N2O4(g)△H=-57kJ/mol;当向A中加入2g苛性钠时: 如图是由一些常见元素组成的单质及其化合物之间的转化关系图.常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去).请回答下列问题:
如图是由一些常见元素组成的单质及其化合物之间的转化关系图.常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去).请回答下列问题: