题目内容
常温时,将V1mLc1mol?L-1的氨水滴加到V2mLc2mol?L-1的盐酸中,下述结论一定正确的是( )
| A、若V1≥V2,c1=c2,则混合液的pH>7 |
| B、若混合溶液的pH=7,则c1V1<c2V2 |
| C、若c1=c2,混合液中c(NH4+)═c(Cl-),则V1>V2 |
| D、若混合溶液的pH>7,则混合液中c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.若v1=v2 c1=c2,一水合氨与氯化氢的物质的量相等,二者恰好完全反应生成氯化铵,铵离子部分水解,溶液显示酸性;若V1≥V2,c1=c2,溶液可能为酸性、中性或者碱性;
B.混合液的pH=7,由于c1V1=c2V2时溶液显示酸性,所以若显示中性,必须满足氨水过量,即c1V1>c2V2;
C.c(NH4+)=c(Cl-),根据电荷守恒可知溶液中c(H+)=c(OH-),说明氨水稍稍过量;
D.若混合溶液的pH>7,溶液显示碱性,氨水可以稍稍过量,也可以远远大于氯化氢,所以无法判断c(OH-)和c(Cl-)的大小.
B.混合液的pH=7,由于c1V1=c2V2时溶液显示酸性,所以若显示中性,必须满足氨水过量,即c1V1>c2V2;
C.c(NH4+)=c(Cl-),根据电荷守恒可知溶液中c(H+)=c(OH-),说明氨水稍稍过量;
D.若混合溶液的pH>7,溶液显示碱性,氨水可以稍稍过量,也可以远远大于氯化氢,所以无法判断c(OH-)和c(Cl-)的大小.
解答:
解:A.当v1=v2 c1=c2时,两溶液恰好完全反应,反应后的溶质为氯化铵,铵离子部分水解,溶液显示酸性;若V1≥V2,c1=c2,则c1V1>c2V2,氨水过量,溶液可能显示酸性、中性或者碱性,故A错误;
B.若混合液的pH=7,则c(H+)=c(OH-),根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+c(C1-)可知:混合液中c(NH4+)=c(C1-),由于溶液中存在一水合氨分子,根据物料守恒可知氨水过量,即c1V1>c2V2,故B错误;
C.c(NH4+)=c(C1-),根据电荷守恒可知溶液中c(H+)=c(OH-),溶液为中性,所以氨水必须过量,即c1V1>c2V2,由于c1=c2,则V1>V2,故C正确;
D.若混合溶液的pH>7,说明溶液显示碱性,即溶液中c(H+)<c(OH-),根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+c(C1-)可知,c(NH4+)>c(C1-),而c(OH-)和c(Cl-)的大小无法确定,若氨水远远过量,则c(OH-)>c(Cl-),若氨水稍稍过量,则c(OH-)<c(Cl-),故D错误;
故选C.
B.若混合液的pH=7,则c(H+)=c(OH-),根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+c(C1-)可知:混合液中c(NH4+)=c(C1-),由于溶液中存在一水合氨分子,根据物料守恒可知氨水过量,即c1V1>c2V2,故B错误;
C.c(NH4+)=c(C1-),根据电荷守恒可知溶液中c(H+)=c(OH-),溶液为中性,所以氨水必须过量,即c1V1>c2V2,由于c1=c2,则V1>V2,故C正确;
D.若混合溶液的pH>7,说明溶液显示碱性,即溶液中c(H+)<c(OH-),根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+c(C1-)可知,c(NH4+)>c(C1-),而c(OH-)和c(Cl-)的大小无法确定,若氨水远远过量,则c(OH-)>c(Cl-),若氨水稍稍过量,则c(OH-)<c(Cl-),故D错误;
故选C.
点评:本题考查了酸碱混合时的定性判断及有关pH的简单计算,题目难度中等,注意掌握判断酸碱溶液混合后溶液酸碱性及溶液中离子浓度大小的方法,能够利用电荷守恒、盐的水解判断离子浓度大小;选项D为易错点,注意c(OH-)和c(Cl-)的大小无法确定.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
下列有关表述正确的是( )
| A、-OH与OH-组成元素相同,含有的质子数也相同 |
B、NH4Cl的电子式为: |
C、丙烷分子的比例模型示意图: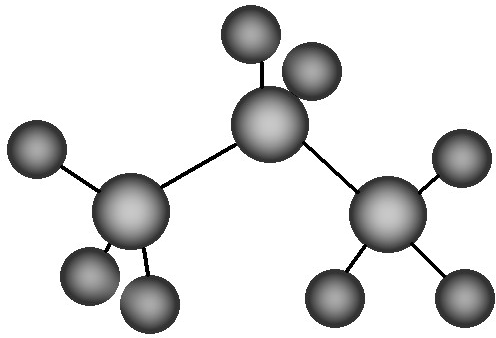 |
D、CO2分子的比例模型示意图: |
下列说法正确的是( )
| A、Ksp越小,则该物质在水中的溶解度肯定越小 |
| B、Ksp小的物质不可能转化为Ksp大的物质 |
| C、Ksp的大小只取决于物质属性,而与温度等其它因素无关 |
| D、易溶于水的物质也可能存在沉淀溶解平衡 |
对于难溶盐MX,其饱和溶液的Mn+和Xn-离子的物质的量浓度之间的关系近似于水的离子积Kw(Kw=c(OH-) c(H+)),存在着c(Mn+) c(Xn-)=K的关系(K为常数).现将足量的AgCl固体分别放入下列物质中:
①10mL蒸馏水 ②40mL 0.03mol/L盐酸
③50mL 0.05mol/LAgNO3溶液 ④30mL 0.02mol/LCaCl2溶液
AgCl的溶解度由大到小排列的顺序是( )
①10mL蒸馏水 ②40mL 0.03mol/L盐酸
③50mL 0.05mol/LAgNO3溶液 ④30mL 0.02mol/LCaCl2溶液
AgCl的溶解度由大到小排列的顺序是( )
| A、①>②>④>③ |
| B、②>③>④>① |
| C、①>②>③>④ |
| D、③>②>④>① |
X、Y、Z、W、R、Q是6种短周期主族元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R、Q处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法不正确的是( )
| A、同周期元素的离子中W离子半径最小 |
| B、元素X能与元素Y形成共价化合物X2Y2 |
| C、工业上用二氧化锰和浓盐酸制取Q的单质 |
| D、元素Z、W、R的最高价氧化物对应的水化物之间均能反应 |
下列溶液中有关物质的量浓度关系正确的是( )
| A、Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、相同条件下,pH=5的 ①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③ |
| C、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| D、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
 氧化还原反应在生产、生活中具有广泛的用途.
氧化还原反应在生产、生活中具有广泛的用途. 依据叙述,写出下列反应的热化学方程式.
依据叙述,写出下列反应的热化学方程式.