题目内容
(1)除去Fe2O3粉末中少量的Al2O3用 (填试剂)
(2)检验CO2中混有的SO2用 (填试剂)
(2)检验CO2中混有的SO2用
考点:物质的分离、提纯的基本方法选择与应用,物质的检验和鉴别的基本方法选择及应用
专题:化学实验基本操作
分析:(1)Fe2O3中混有Al2O3,二者都难溶于水,根据分类和性质Fe2O3是碱性氧化物,具有碱性氧化物的通性,溶于酸而不溶于碱;Al2O3是两性氧化物,具有两性氧化物的通性,溶于强酸强碱.所以可把混合物加入强碱溶液中,然后过滤,可得较纯的Fe2O3;
(2)根据二氧化硫具有漂白性,能够使品红褪色,而二氧化碳不具有此性质,可以据此检验二氧化硫的存在情况.
(2)根据二氧化硫具有漂白性,能够使品红褪色,而二氧化碳不具有此性质,可以据此检验二氧化硫的存在情况.
解答:
解:(1)Fe2O3不与氢氧化钠溶液反应,而Al2O3能和氢氧化钠溶液反应,反应的化学方程式为:Al2O3+2OH-=2AIO2-+H2O,然后过滤得到Fe2O3,
故答案为:NaOH溶液;
(2)可以使用品红溶液检验二氧化碳中是否含有二氧化硫,方法为:将混合气体通过品红溶液,若品红溶液褪色,则说明混有SO2气体,
故答案为:品红溶液.
故答案为:NaOH溶液;
(2)可以使用品红溶液检验二氧化碳中是否含有二氧化硫,方法为:将混合气体通过品红溶液,若品红溶液褪色,则说明混有SO2气体,
故答案为:品红溶液.
点评:本题考查了物质的分离与提纯、物质的检验与鉴别方法,难度不大,注意明确除杂的原则是:不能引入新的杂质,不能反应掉需提纯的物质,把杂质变为沉淀、气体或溶解除去.

练习册系列答案
相关题目
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A、Cu2+、NH4+、Br-、OH- |
| B、Ag+、NO3-、Cl-、K+ |
| C、K+、Ba2+、OH-、SO42- |
| D、H+、NO3-、Fe2+、Na+ |
下列有关表述正确的是( )
| A、-OH与OH-组成元素相同,含有的质子数也相同 |
B、NH4Cl的电子式为: |
C、丙烷分子的比例模型示意图: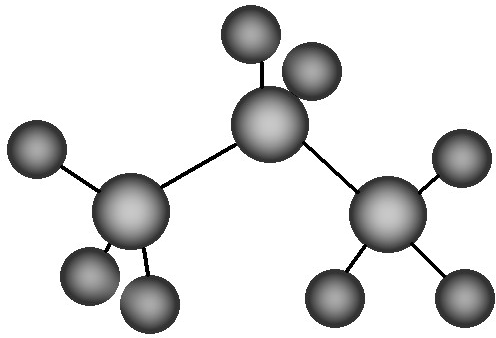 |
D、CO2分子的比例模型示意图: |
下列溶液中有关物质的量浓度关系正确的是( )
| A、Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、相同条件下,pH=5的 ①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③ |
| C、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| D、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
 氧化还原反应在生产、生活中具有广泛的用途.
氧化还原反应在生产、生活中具有广泛的用途. 2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.
2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.