题目内容
0.100mol.L-1的Na2S的溶液中,下列关系不正确的是( )
| A、[H2S]+[HS-]+[S2-]=0.1 |
| B、[Na+]+[H+]=2[S2-]+[HS-]+[OH-] |
| C、[OH-]=[H+]+[HS-]+2[H2S] |
| D、[Na+]+[H+]=[S2-]+[HS-]+[OH-] |
考点:离子浓度大小的比较
专题:
分析:0.100mol.L-1的Na2S的溶液中,硫离子部分水解,溶液显示碱性,溶液中存在的粒子有:H2S、HS-、S2-、OH-、H+、Na+,根据物料守恒可得:[H2S]+[HS-]+[S2-]=0.1mol/L;根据质子守恒可得:[OH-]=[H+]+[HS-]+2[H2S];根据电荷守恒可得:[Na+]+[H+]=2[S2-]+[HS-]+[OH-],据此进行判断.
解答:
解:A.0.100mol.L-1的Na2S的溶液中,根据物料守恒可得:[H2S]+[HS-]+[S2-]=0.1mol/L,题中缺少单位,故A错误;
B.根据硫化钠溶液中的电荷守恒可得:[H2S]+[HS-]+[S2-]=0.1mol/L,故B正确;
C.溶液中满足质子守恒,根据硫化钠溶液中的质子守恒可得:[OH-]=[H+]+[HS-]+2[H2S],故C正确;
D.硫离子带有两个单位负电荷,其系数应该为2,正确的电荷守恒为:[Na+]+[H+]=2[S2-]+[HS-]+[OH-],故D错误;
故选AD.
B.根据硫化钠溶液中的电荷守恒可得:[H2S]+[HS-]+[S2-]=0.1mol/L,故B正确;
C.溶液中满足质子守恒,根据硫化钠溶液中的质子守恒可得:[OH-]=[H+]+[HS-]+2[H2S],故C正确;
D.硫离子带有两个单位负电荷,其系数应该为2,正确的电荷守恒为:[Na+]+[H+]=2[S2-]+[HS-]+[OH-],故D错误;
故选AD.
点评:本题考查了混合溶液中离子浓度大小比较,为高考常见题型,侧重于学生的分析能力的考查,题目难度中等,注意电荷守恒、质子守恒及物料守恒的运用方法.

练习册系列答案
相关题目
下列与生活相关的叙述错误的是( )
| A、酸性臭氧水(AOW)可用于消灭HlNl病毒,因为臭氧具有强氧化性 |
| B、水的处理常用到漂白粉和明矾,二者的作用原理相同 |
| C、二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成 |
| D、地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列有关说法正确的是( )
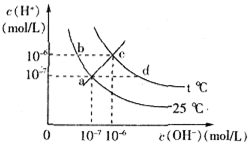

| A、c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B、将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C、t℃>25℃ |
| D、ac线上的任意一点均有pH=7 |
在合成氨工业中,为增加氨气的日产量,在过程中与平衡移动无关的是( )
| A、不断分离出液氨 |
| B、使用催化剂 |
| C、采用500℃的高温 |
| D、采用20-50Mp的压强 |
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
| A、9.5 | B、10.5 |
| C、11.5 | D、12.5 |
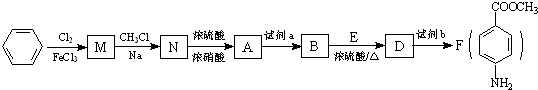
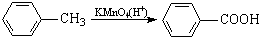


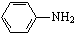 最多能够和
最多能够和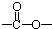 结构;
结构;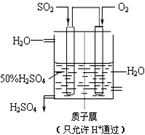 工业上生产硫酸时,将SO2氧化为SO3是关键一步.
工业上生产硫酸时,将SO2氧化为SO3是关键一步.