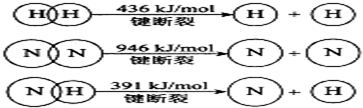
题目内容
(1)某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等.为确定其组成,分别进行下列4组实验
①其中能确认样品中不含SO32-的实验操作是 (填下列实验操作序号);根据实验结果,你认为是否含有N02-? (填“含有”、“不含有”),其原因是 ;
A.取试样,滴加适量的淀粉KI溶液,呈蓝色;
B.取试样,滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
C.取试样,滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
D.取试样,滴加酸性KMnO4溶液,不褪色.
②书写A实验现象的离子方程式 ,C 实验说明酸雨中含
(2)某废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的一种处理方法为还原沉淀法.该法的工艺流程为:
CrO2-
CrO2-
Cr3+
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
①第①步中若平衡体系的pH=1,该溶液中含Cr元素的微粒是 .
②第②步中,还原1molCr2O72-离子,需要 mol的FeSO4?7H2O.
③第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 .
①其中能确认样品中不含SO32-的实验操作是
A.取试样,滴加适量的淀粉KI溶液,呈蓝色;
B.取试样,滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
C.取试样,滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
D.取试样,滴加酸性KMnO4溶液,不褪色.
②书写A实验现象的离子方程式
(2)某废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的一种处理方法为还原沉淀法.该法的工艺流程为:
CrO2-
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
①第①步中若平衡体系的pH=1,该溶液中含Cr元素的微粒是
②第②步中,还原1molCr2O72-离子,需要
③第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
考点:常见离子的检验方法,离子方程式的书写,难溶电解质的溶解平衡及沉淀转化的本质
专题:离子反应专题,电离平衡与溶液的pH专题
分析:(1)①A.滴加适量的淀粉KI溶液,呈蓝色,说明存在氧化性离子N03-,所以没有SO32-;
B.滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,说明含有硫酸根离子;
C.滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明含有铵根离子;
D.取试样,滴加酸性KMnO4溶液,不褪色,说明没有还原性离子SO32-;
N02-能够被酸性KMnO4溶液氧化,而使KMnO4溶液褪色,而实验D中KMnO4溶液不褪色,所以不含N02-;
②碘化钾与硝酸反应生成一氧化氮、碘和水;
滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明含有铵根离子;
(2)①根据可逆反应的特点进行判断;
②根据氧化还原反应中得失电子守恒来计算;
③根据溶度积常数以及水的离子积常数来进行计算.
B.滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,说明含有硫酸根离子;
C.滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明含有铵根离子;
D.取试样,滴加酸性KMnO4溶液,不褪色,说明没有还原性离子SO32-;
N02-能够被酸性KMnO4溶液氧化,而使KMnO4溶液褪色,而实验D中KMnO4溶液不褪色,所以不含N02-;
②碘化钾与硝酸反应生成一氧化氮、碘和水;
滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明含有铵根离子;
(2)①根据可逆反应的特点进行判断;
②根据氧化还原反应中得失电子守恒来计算;
③根据溶度积常数以及水的离子积常数来进行计算.
解答:
解:(1)①A.滴加适量的淀粉KI溶液,呈蓝色,说明存在氧化性离子N03-,所以没有SO32-,故A可选;
B.滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,说明含有硫酸根离子,故B不选;
C.滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明含有铵根离子,故C不选;
D.取试样,滴加酸性KMnO4溶液,不褪色,说明没有还原性离子SO32-,故D可选;
故答案为AD;
因为N02-能够被酸性KMnO4溶液氧化,而使KMnO4溶液褪色,而实验D中KMnO4溶液不褪色,所以不含N02-,
故答案为:不含有,若有N02-,能使酸性KMnO4溶液褪色;
②碘化钾与硝酸反应生成一氧化氮、碘和水,方程式为:2N03-+6I-+8H+=2N0↑+3I2+4H2O,
滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明含有铵根离子;
故答案为:2N03-+6I-+8H+=2N0↑+3I2+4H2O;NH4+;
(2)①2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,故溶液中含Cr元素的微粒是,Cr2O72-和CrO42-,
故答案为:Cr2O72-和CrO42-;
②根据电子得失守恒:n(Cr2O72-)×6=n(FeSO4?7H2O)×1,n(FeSO4?7H2O)=
=6mol,
故答案为:6;
③当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=
=10-9 mol/L,c(H+)═
=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,
故答案为:5.
B.滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,说明含有硫酸根离子,故B不选;
C.滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明含有铵根离子,故C不选;
D.取试样,滴加酸性KMnO4溶液,不褪色,说明没有还原性离子SO32-,故D可选;
故答案为AD;
因为N02-能够被酸性KMnO4溶液氧化,而使KMnO4溶液褪色,而实验D中KMnO4溶液不褪色,所以不含N02-,
故答案为:不含有,若有N02-,能使酸性KMnO4溶液褪色;
②碘化钾与硝酸反应生成一氧化氮、碘和水,方程式为:2N03-+6I-+8H+=2N0↑+3I2+4H2O,
滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明含有铵根离子;
故答案为:2N03-+6I-+8H+=2N0↑+3I2+4H2O;NH4+;
(2)①2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,故溶液中含Cr元素的微粒是,Cr2O72-和CrO42-,
故答案为:Cr2O72-和CrO42-;
②根据电子得失守恒:n(Cr2O72-)×6=n(FeSO4?7H2O)×1,n(FeSO4?7H2O)=
| 1mol×6 |
| 1 |
故答案为:6;
③当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=
| 3 |
| ||
| 10-14 |
| 10-9 |
故答案为:5.
点评:本题考查几种常见离子的检验方法、氧化还原反应离子方程式的书写、可逆反应的特点、物质的量的相关计算及沉淀溶解平衡等知识,综合性较强,难度较大.

练习册系列答案
相关题目
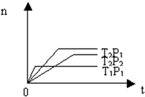 反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )| A、T1<T2,P1<P2 |
| B、T1<T2,P1>P2 |
| C、T1>T2,P1>P2 |
| D、T1>T2,P1<P2 |
1-氯丙烷与强碱的醇溶液共热后,生成的产物再与溴水反应,得到一种有机物A,A的同分异构体(包括A)共有( )
| A、3钟 | B、4种 | C、5种 | D、6种 |
0.100mol.L-1的Na2S的溶液中,下列关系不正确的是( )
| A、[H2S]+[HS-]+[S2-]=0.1 |
| B、[Na+]+[H+]=2[S2-]+[HS-]+[OH-] |
| C、[OH-]=[H+]+[HS-]+2[H2S] |
| D、[Na+]+[H+]=[S2-]+[HS-]+[OH-] |
在水中加入下列物质,可使水的电离平衡向右移动的是( )
| A、硫酸 | B、氢氧化钾 |
| C、氯化铁 | D、硝酸钡 |
下列说法正确的是( )
| A、已知氢元素有1H、2H、3H三种同位素,氧元素有16O、18O两种同位素,则它们之间形成的化合物有30种 | ||||||||
| B、能够使pH试纸显红色的溶液pH一定大于7 | ||||||||
| C、已知反应:2(CaO?MgO)(s)+Si(s)?CaSiO4(l)+2Mg(g),在密闭的还原炉内达到平衡后,若其他条件均不改变,将还原炉体积缩小一半,则达到新平衡是Mg(g)的浓度将升高 | ||||||||
D、
|
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2十H2O═ZnO+2MnO (OH).下列说法正确的是( )
| A、该电池的正极为锌 |
| B、电池正极反应式为:2MnO2+2e-+2H2O═2MnO (OH)+2OH- |
| C、当 0.l mol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 |
| D、该电池反应中二氧化锰起催化剂作用 |
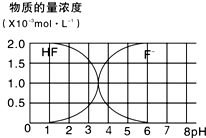 (1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.