题目内容
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列有关说法正确的是( )
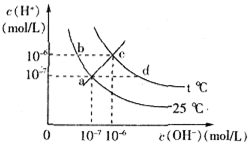

| A、c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B、将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C、t℃>25℃ |
| D、ac线上的任意一点均有pH=7 |
考点:离子积常数,水的电离
专题:电离平衡与溶液的pH专题
分析:A.c点对应的溶液中c(H+)=c(OH-),溶液呈中性,Al3+、CO32-相互促进水解;
B.水的电离是吸热反应,升高温度促进水电离,则水中离子积常数增大,中性溶液中c(H+)=c(OH-),将25℃时的NaCl溶液加热到t℃,该溶液中仍然存在c(H+)=c(OH-);
C.水的电离是吸热反应,升高温度促进水电离,则水中离子积常数增大;
D.ac线是溶液呈中性时的线,该线上的任意一点溶液均呈中性,但pH从a到c逐渐减小.
B.水的电离是吸热反应,升高温度促进水电离,则水中离子积常数增大,中性溶液中c(H+)=c(OH-),将25℃时的NaCl溶液加热到t℃,该溶液中仍然存在c(H+)=c(OH-);
C.水的电离是吸热反应,升高温度促进水电离,则水中离子积常数增大;
D.ac线是溶液呈中性时的线,该线上的任意一点溶液均呈中性,但pH从a到c逐渐减小.
解答:
解:A.c点c(H+)=c(OH-),溶液为中性,Al3+、CO32-相互促进水解而不能大量共存,故A错误;
B.将25℃时的NaCl溶液加热到t℃,升高温度促进水电离,则该溶液中的c(OH-)要增大而不是减小,故B错误;
C.t℃时水的电离程度增大,故温度升高水的离子积常数增大,故C正确;
D.a点pH=7,c点pH=6,ac线上的任意一点的pH介于6~7之间,故D错误;
故选C.
B.将25℃时的NaCl溶液加热到t℃,升高温度促进水电离,则该溶液中的c(OH-)要增大而不是减小,故B错误;
C.t℃时水的电离程度增大,故温度升高水的离子积常数增大,故C正确;
D.a点pH=7,c点pH=6,ac线上的任意一点的pH介于6~7之间,故D错误;
故选C.
点评:本题考查离子积常数,明确该图象中纵横坐标的含义是解本题关键,知道ac线是中性溶液,知道离子积常数只与温度有关,与溶液酸碱性及浓度无关,为易错题.

练习册系列答案
相关题目
芳香烃是指( )
| A、分子里含有苯环的化合物 |
| B、分子组成符合CnH2n-6 通式的一类有机物 |
| C、分子里含有一个或多个苯环的烃 |
| D、苯和苯的同系物的总称 |
下列反应不能通过一步反应得到的是( )
| A、Na2CO3→NaHCO3 |
| B、SiO2→H2SiO3 |
| C、Fe(OH)2→Fe(OH)3 |
| D、NH4Cl→NH3 |
向硝酸钠溶液中加入铜粉不发生反应,若加入某种盐,则铜粉可以逐渐溶解,符合此条件的是( )
| A、Fe(NO3)2 |
| B、ZnSO4 |
| C、NaHCO3 |
| D、NaHSO4 |
0.100mol.L-1的Na2S的溶液中,下列关系不正确的是( )
| A、[H2S]+[HS-]+[S2-]=0.1 |
| B、[Na+]+[H+]=2[S2-]+[HS-]+[OH-] |
| C、[OH-]=[H+]+[HS-]+2[H2S] |
| D、[Na+]+[H+]=[S2-]+[HS-]+[OH-] |
向一定浓度的NaHCO3溶液中加入适量下列物质,能使HCO3-数目减少,CO32-数目增加的是( )
| A、稀盐酸 |
| B、Ba(OH)2溶液 |
| C、NaOH溶液 |
| D、Na2SO4溶液 |
以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A、53g碳酸钠中含NA个CO32- |
| B、标准状况下11.2L臭氧中含NA个氧原子 |
| C、1.8g水中含NA个中子 |
| D、0.1molOH-含NA个电子 |