题目内容
 工业上生产硫酸时,将SO2氧化为SO3是关键一步.
工业上生产硫酸时,将SO2氧化为SO3是关键一步.(1)某温度下,SO2(g)+
| 1 |
| 2 |
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)?2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度
F.移动活塞压缩气体
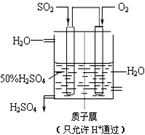
(3)某人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
(4)在0.1mol?L-1的(NH4)2SO4溶液中,离子浓度由大到小的顺序是
考点:用化学平衡常数进行计算,原电池和电解池的工作原理,化学平衡的影响因素,离子浓度大小的比较
专题:
分析:(1)依据化学平衡三段式列式计算得到;
(2)根据平衡移动的方向判断;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-;
(4)硫酸铵溶液中铵根离子水解溶液呈酸性,依据离子浓度大小分析;
(2)根据平衡移动的方向判断;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-;
(4)硫酸铵溶液中铵根离子水解溶液呈酸性,依据离子浓度大小分析;
解答:
解:(1)某温度下,SO2(g)+
O2(g)?SO3(g);△H=-98kJ?mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),当反应达到平衡时共放出热量196kJ,消耗二氧化硫物质的量为:
=2mol,平衡三段式得到
2 SO2(g)+O2(g)?2SO3(g);△H=-196kJ?mol-1.
起始量(mol) 4 5 0
变化量(mol) 2 1 2 196KJ
平衡量(mol) 2 4 2
该温度下平衡常数K=
=
=2.5L/mol
故答案为:2.5L/mol;
(2)A.保持温度和容器体积不变,充入2mol SO3,平衡向逆反应分析移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故A正确;
B.保持温度和容器体积不变,充入2mol N2,对平衡移动没有影响,各物质的浓度不变,故B错误;
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2,平衡向正反应方向移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故C正确;
D.保持温度和容器内压强不变,充入1mol SO3,处于等效平衡状态,浓度不变,故D错误;
E.升高温度,平衡向逆反应分析移动,SO3的浓度减小,故E错误;
F.移动活塞压缩气体,体积减小,各物质的浓度都增大,故F正确.
故答案为:A、C、F;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-,负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)在0.1mol?L-1的(NH4)2SO4溶液中,硫酸铵溶液中铵根离子水解溶液呈酸性,离子浓度由大到小的顺序是c(NH4+)>c (SO42-)>c (H+)>c (OH-);
故答案为:c(NH4+)>c (SO42-)>c (H+)>c (OH-);
| 1 |
| 2 |
| 196 |
| 98 |
2 SO2(g)+O2(g)?2SO3(g);△H=-196kJ?mol-1.
起始量(mol) 4 5 0
变化量(mol) 2 1 2 196KJ
平衡量(mol) 2 4 2
该温度下平衡常数K=
| [SO3]2 |
| [SO2]2?[O2] |
(
| ||||
(
|
故答案为:2.5L/mol;
(2)A.保持温度和容器体积不变,充入2mol SO3,平衡向逆反应分析移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故A正确;
B.保持温度和容器体积不变,充入2mol N2,对平衡移动没有影响,各物质的浓度不变,故B错误;
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2,平衡向正反应方向移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故C正确;
D.保持温度和容器内压强不变,充入1mol SO3,处于等效平衡状态,浓度不变,故D错误;
E.升高温度,平衡向逆反应分析移动,SO3的浓度减小,故E错误;
F.移动活塞压缩气体,体积减小,各物质的浓度都增大,故F正确.
故答案为:A、C、F;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-,负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)在0.1mol?L-1的(NH4)2SO4溶液中,硫酸铵溶液中铵根离子水解溶液呈酸性,离子浓度由大到小的顺序是c(NH4+)>c (SO42-)>c (H+)>c (OH-);
故答案为:c(NH4+)>c (SO42-)>c (H+)>c (OH-);
点评:本题考查了化学平衡的分析判断,平衡常数的计算应用,原电池原理的应用,溶液中离子浓度大小比较,平衡影响因素的分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素中子数与核外电子数之差是( )
| A、57 | B、47 | C、64 | D、293 |
下列实验操作正确的是( )
| A、玻璃仪器外壁有水可以直接用酒精灯加热 |
| B、把鼻孔凑近瓶口闻药品的气味 |
| C、酒精灯用完后,可用嘴吹灭 |
| D、实验用剩的药品一般不能随意丢弃,也不放回原瓶,但实验剩余的金属钠必须放回原瓶 |
芳香烃是指( )
| A、分子里含有苯环的化合物 |
| B、分子组成符合CnH2n-6 通式的一类有机物 |
| C、分子里含有一个或多个苯环的烃 |
| D、苯和苯的同系物的总称 |
1-氯丙烷与强碱的醇溶液共热后,生成的产物再与溴水反应,得到一种有机物A,A的同分异构体(包括A)共有( )
| A、3钟 | B、4种 | C、5种 | D、6种 |
下列反应不能通过一步反应得到的是( )
| A、Na2CO3→NaHCO3 |
| B、SiO2→H2SiO3 |
| C、Fe(OH)2→Fe(OH)3 |
| D、NH4Cl→NH3 |
0.100mol.L-1的Na2S的溶液中,下列关系不正确的是( )
| A、[H2S]+[HS-]+[S2-]=0.1 |
| B、[Na+]+[H+]=2[S2-]+[HS-]+[OH-] |
| C、[OH-]=[H+]+[HS-]+2[H2S] |
| D、[Na+]+[H+]=[S2-]+[HS-]+[OH-] |
下列图示与对应的叙述相符的是( )


| A、由图甲可以判断:T1>T2,且反应的△H<0 |
| B、图乙表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、根据图丙,若除去CuSO4溶液中的Fe2+,可先向溶液中加入适量双氧水,再调节pH≈4 |
| D、图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
 合成气(CO和H2为主的混合气体)不但是重要的燃料,也是重要的化工原料,图中曲线Ⅰ和Ⅱ是两种合成CO和H2反应的能量变化图.
合成气(CO和H2为主的混合气体)不但是重要的燃料,也是重要的化工原料,图中曲线Ⅰ和Ⅱ是两种合成CO和H2反应的能量变化图.