题目内容
19.下列由实验事实所列出的相应结论正确的是( )| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,与同浓度的硫酸反应析出流沉淀所需的时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率增大 |
| B | 用铜作电极电解CuSO4溶液,CuSO4溶液浓度不变 | Cu2+没有参与电极反应 |
| C | 在常温下N2不能与O2反应,而白磷却能自燃 | 氮元素的非金属性比磷元素的弱 |
| D | 醋酸能与碱反应 | 醋酸分子一定不能存在于碱性溶液中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓度越大,单位体积活化分子数目增多,则反应速率越大;
B.相当于电解精炼铜,铜离子参与了电极反应;
C.氮气中氮原子之间形成氮氮三键,故化学性质稳定,白磷中P原子间形成P-P,故性质较活泼;
D.醋酸钠溶液显碱性,存在醋酸分子.
解答 解:A.与同浓度的硫酸反应析出流沉淀所需的时间越短,说明反应速率越快,从而证明当其他条件不变时,增大反应物浓度,化学反应速率增大,故A正确;
B.用铜作电极电解CuSO4溶液,阳极铜失去电子生成铜离子,阴极铜离子得到电子生成铜,则CuSO4溶液浓度不变,但铜离子参与反应,故B错误;
C.氮气中氮原子之间形成氮氮三键,其化学性质稳定,白磷中P原子间形成P-P键,其性质较活泼,N与P在同一主族,且N在P的上一周期,则非金属性N>P,故C错误;
D.因为醋酸根离子的水解,醋酸钠溶液显碱性,醋酸钠溶液中存在醋酸分子,故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及反应速率的影响因素、电解原理、盐的水解原理、非金属性强弱判断等知识,注意掌握原电池原理、化学反应速率的影响,C为易错点,注意掌握判断非金属性强弱的方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
10.向100mL 0.25mol•L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
| A. | 2.3 g | B. | 3.45 g | C. | 1.15 g | D. | 0.575 g |
7.配制500mL 0.5mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为10.0g.
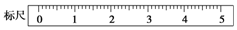
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘.欲使天平平衡,所进行的操作为将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡.假定最终称得小烧杯的质量为32.6(填“32.6g”或“31.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示).
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温.
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm.
③将NaOH溶液沿玻璃棒注入500mL容量瓶中.
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶.
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作排出先后顺序①③④②⑤.
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是ACD.
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度.
(1)计算:需要NaOH固体的质量为10.0g.
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘.欲使天平平衡,所进行的操作为将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡.假定最终称得小烧杯的质量为32.6(填“32.6g”或“31.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示).
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |

(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温.
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm.
③将NaOH溶液沿玻璃棒注入500mL容量瓶中.
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶.
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作排出先后顺序①③④②⑤.
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是ACD.
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度.
14.下列各组离子在所给条件下能大量共存的是( )
| A. | 在含有大量Fe3+的溶液中:Na+,SCN-,SO42-,NO3- | |
| B. | 在pH=1的溶液中:Fe3+,Mg2+,Cl-,SO42- | |
| C. | 在加入了FeSO4•7H2O晶体溶液中:Na+,H+,Cl-,NO3- | |
| D. | 能使紫色石蕊试液变红的溶液中:K+,HCO3-,NO3-,S2- |
11.下列实验设计不能达到预期目的是( )
| 实验设计 | 预期目的 | |
| A | 在相同温度下,分别取等质量的大理石块、大理石粉末分别与等体积等浓度的稀硫酸反应 | 探究反应物接触面积对化学反应速率的影响 |
| B | 把盛有颜色相同的NO2和N2O4的混合气体的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 将铁棒和石墨用导线连接后插入含有Fe2+、Cu2+的盐溶液中 | 探究Fe2+和Cu2+的氧化性相对强弱 |
| D | 相同温度下,向两支盛有等体积等浓度H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液 | 探究不同催化剂对同一反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法正确的是( )
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 酒精、硫酸钡和水分别属于电解质、强电解质和弱电解质 | |
| C. | 胶体区别于其它分散系的本质特性是具有丁达尔现象 | |
| D. | 利用半透膜可除去淀粉溶液中的少量NaCl |
9.常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
| A. | 某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a | |
| B. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+) |
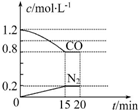 “霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
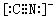 .
.