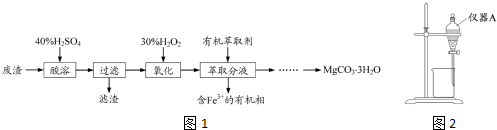
题目内容
10.向100mL 0.25mol•L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )| A. | 2.3 g | B. | 3.45 g | C. | 1.15 g | D. | 0.575 g |
分析 根据Cl元素守恒有n(NaCl)=3n(AlCl3),根据Al元素守恒有n(NaAlO2)=n(AlCl3),根据Na元素守恒有n(Na)=n(NaCl)+n(NaAlO2),再结合m=nM计算加入金属钠的质量.
解答 解:100mL 0.25mol/L的AlCl3溶液中n(AlCl3)=0.1L×0.25mol/L=0.025mol,
根据Cl元素守恒有:n(NaCl)=3n(AlCl3)=3×0.025mol=0.075mol,
根据Al元素守恒有:n(NaAlO2)=n(AlCl3)=0.025mol,
所以加入金属钠的物质的量为:n(Na)=n(NaCl)+n(NaAlO2)=0.075mol+0.025mol=0.1mol,
则加入的Na的物质的量为:0.1mol×23g/mol=2.3g,
故选A.
点评 本题考查化学方程式的有关计算,题目难度中等,注意从元素守恒解答,可省去书写化学方程式的中间过程,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | H2O与D2O互为同位素 | B. | 纤维素与淀粉互为同分异构体 | ||
| C. | 干冰和冰为同一种物质 | D. | 甲烷和十六烷互为同系物 |
5.下列物质的贮存方法不正确的是( )
| A. | 液氯储存在钢瓶中 | B. | 液溴装入试剂瓶中应加少量水液封 | ||
| C. | 固体碘保存在CCl4中 | D. | 氢氟酸盛放在塑料瓶中 |
2.已知反应:3BrF3+5H2O=HBrO3+9HF+O2↑+Br2,如有3mol H2O参加反应,则被H2O还原的BrF3的物质的量为( )
| A. | 1.2mol | B. | 2mol | C. | 0.8mol | D. | 1.8mol |
19.下列由实验事实所列出的相应结论正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,与同浓度的硫酸反应析出流沉淀所需的时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率增大 |
| B | 用铜作电极电解CuSO4溶液,CuSO4溶液浓度不变 | Cu2+没有参与电极反应 |
| C | 在常温下N2不能与O2反应,而白磷却能自燃 | 氮元素的非金属性比磷元素的弱 |
| D | 醋酸能与碱反应 | 醋酸分子一定不能存在于碱性溶液中 |
| A. | A | B. | B | C. | C | D. | D |
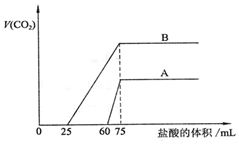 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸体积之间的关系如图所示,试回答下列问题: