题目内容
8.${\;}_{6}^{12}$C原子的质量约为( )| A. | 2×10-23g | B. | 2×10-24g | C. | 2×10-25g | D. | 2×10-26g |
分析 1mol${\;}_{6}^{12}$C的质量为:1mol×12g/mol=12g,即6.02×1023个${\;}_{6}^{12}$C的质量为:12g,由此求1个${\;}_{6}^{12}$C的质量.
解答 解:1mol${\;}_{6}^{12}$C的质量为:1mol×12g/mol=12g,即6.02×1023个${\;}_{6}^{12}$C的质量为:12g,所以1个${\;}_{6}^{12}$C的质量为$\frac{12g}{6.02×1{0}^{23}}$=2×10-23g,故选A.
点评 本题考查物质的量的相关计算,学生要熟练掌握公式,如N=$\frac{n}{{N}_{A}}$进行计算求解,比较容易.

练习册系列答案
相关题目
18.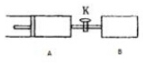 如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )
如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )
 如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )
如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )| A. | 两容器中的反应分别达到平衡时,反应物X的速率:v(B)>v(A) | |
| B. | A容器中x的转化率为80% | |
| C. | 平衡时的压强:PA<PB | |
| D. | 平衡时Y体积分数:A>B |
19.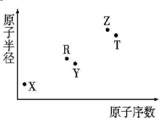 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )
 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )| A. | X和Y组成的化合物的水溶液保存在塑料瓶中 | |
| B. | 原子半径和离子半径均满足:Y<Z | |
| C. | 最高价氧化物对应的水化物酸性:Z>T | |
| D. | 含Z元素的盐溶液一定显酸性 |
16.含有非极性共价键的离子化合物是( )
| A. | HC≡CH | B. | KOH | C. | Na2O2 | D. | CaCl2 |
3.工业上可用还原法制取某些金属单质,以下各项中不属于常用还原剂的是( )
| A. | C | B. | CO | C. | Al | D. | K |
13.某同学用如图所示装置进行氨碱法制取纯碱的主要反应.下列说法合理的是( )
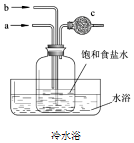

| A. | 先从b管通入NH3再从a管通入CO2 | B. | 先从a管通入CO2再从b管通入NH3 | ||
| C. | 广口瓶内有白色沉淀析出 | D. | c中试剂为碱石灰 |
20.下列有关说法正确的是( )
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | 将 0.1 mol•L-1NH4A1(SO4)2 溶液与 0.3 mol•L-1Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++40H-═AlO2-+2BaSO4↓+2H2O |
17.下列有关装置I~Ⅳ的实验方法及操作的说法正确的是( )
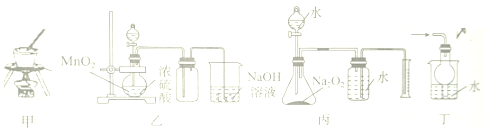

| A. | 利用甲装置甲从海水中提取NaCl晶体 | |
| B. | 利用装置乙制备并收集Cl2 | |
| C. | 利用装置丙测定变质Na2O2的纯度 | |
| D. | 利用装置丁吸收HCl尾气,防止液体倒吸 |