题目内容
16.含有非极性共价键的离子化合物是( )| A. | HC≡CH | B. | KOH | C. | Na2O2 | D. | CaCl2 |
分析 活泼金属和活泼金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物.
解答 解:A.乙炔分子中C原子之间存在非极性共价键、C原子和H原子之间存在极性共价键,为共价化合物,故A错误;
B.KOH中钾离子和氢氧根离子之间存在离子键、O原子和H原子之间存在极性共价键,为离子化合物,故B错误;
C.过氧化钠中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键,故C正确;
D.CaCl2中钙离子和氯离子之间只存在离子键,为离子化合物,故D错误;
故选C.
点评 本题考查了化合物和化学键的关系,明确基本概念是解本题关键,注意不能根据是否含有金属元素判断离子化合物,如氯化铝为共价化合物,铵盐为离子化合物,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.向恒温恒容的密闭容器中充入amolX和bmolY,发生反应X(g)+3Y(g)?2Z(g)达到平衡时,测得X和Y的转化率分别为25%和37.5%.则a:b为( )
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 1:2 |
7.下列实验能达到相应实验目的是( )
| 选项 | 试剂 | 实验目的 | 实验装置 | ||
| X | Y | Z | |||
| A | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 |  |
| B | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
| C | NaCl | 浓硫酸 | AgNO3溶液 | 证明酸性:H2SO4>HCl | |
| D | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
| A. | A | B. | B | C. | C | D. | D |
11.5.5g铁铝混合物与足量的盐酸反应,生成标准状况下的氢气4.48L,则混合物中Fe与Al的物质的量之比( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
1.从滴定管中滴下1滴溶液的体积接近( )
| A. | 0.5mL | B. | 0.1mL | C. | 0.05mL | D. | 0.01mL |
8.${\;}_{6}^{12}$C原子的质量约为( )
| A. | 2×10-23g | B. | 2×10-24g | C. | 2×10-25g | D. | 2×10-26g |
5.设NA表示阿伏伽徳罗常数的数值,下列说法中正确的是( )
| A. | lmolNa2O和Na2O2混合物中含有的阴阳离子总数大于3NA | |
| B. | 常温常压下,20gD2O分子中所含中子数为10NA | |
| C. | 50ml12mol•L-1的盐酸与足量的MnO2共热转移的电子数为0.3 NA | |
| D. | 密闭容器中2mol NO和Imol的O2,充分反应,产物的分子数为2NA |
 、
、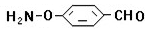 、
、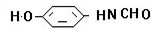 、
、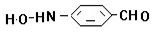 .
.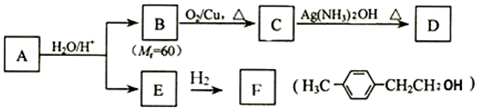
 .
. (其中一种).
(其中一种). )的合成路线.
)的合成路线.