题目内容
19.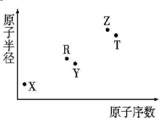 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )| A. | X和Y组成的化合物的水溶液保存在塑料瓶中 | |
| B. | 原子半径和离子半径均满足:Y<Z | |
| C. | 最高价氧化物对应的水化物酸性:Z>T | |
| D. | 含Z元素的盐溶液一定显酸性 |
分析 由短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系图,R与X能形成X2R、X2R2化合物,可知X为H,R为O,结合原子序数大于O,原子半径小于O可知,Y为F元素;Z是地壳中含量最多的金属元素,Z为Al元素;T的原子序数大于Al,T原子最外层电子数是K层电子数的2倍,最外层电子数为4,则T为Si,以此来解答.
解答 解:由上述分析可知,X为H,Y为F,Z为Al,R为O,T为Si,
A.X和Y组成的化合物的水溶液为HF酸,与二氧化硅反应,则保存在塑料瓶中,故A正确;
B.电子层越多,原子半径越大,则原子半径Y<Z,而具有相同电子层结构的离子中原子序数大的离子半径小,则离子半径为Y>Z,故B错误;
C.非金属性Si>Al,则最高价氧化物对应的水化物酸性:Z<T,故C错误;
D.含Z元素的盐溶液,为偏铝酸钠时水解显碱性,为氯化铝时水解显酸性,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子半径、原子序数、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
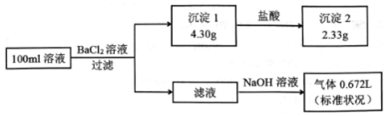

| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 是否存在Na+只有通过焰色反应才能确定 | |
| C. | 原溶液一定存在Na+,可能存在Cl- | |
| D. | 若原溶液中不存在Cl-,则c (Na+)=0.lmol•L-1 |
10.下列离子组能大量共存且加入相应试剂后发生反应的离子方程式正确的是( )
| 离子组 | 加入试剂 | 加入试剂后发生反应 | |
| A | K+、Fe2+、I- | 少量的酸性KMnO4溶液 | 5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O |
| B | Fe3+、I-、SO42- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ba2+、HCO3-、Cl- | NaOH溶液 | HCO3-+OH-═CO32-+H2O |
| D | Al3+、Cl-、NO3- | 过量浓氨水 | Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | A | B. | B | C. | C | D. | D |
7.下列实验能达到相应实验目的是( )
| 选项 | 试剂 | 实验目的 | 实验装置 | ||
| X | Y | Z | |||
| A | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 |  |
| B | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
| C | NaCl | 浓硫酸 | AgNO3溶液 | 证明酸性:H2SO4>HCl | |
| D | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
| A. | A | B. | B | C. | C | D. | D |
14.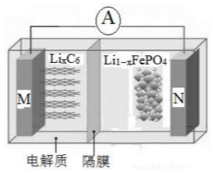 磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )
磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )
 磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )
磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )| A. | 放电时Li+从右边移向左边 | |
| B. | 放电时M是负极,电极反应式为:C6x--xe-═6C | |
| C. | 充电时电路中通过0.5mol电子,消耗36gC | |
| D. | 充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-═Li1-xFeO4+xLi+ |
11.5.5g铁铝混合物与足量的盐酸反应,生成标准状况下的氢气4.48L,则混合物中Fe与Al的物质的量之比( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
8.${\;}_{6}^{12}$C原子的质量约为( )
| A. | 2×10-23g | B. | 2×10-24g | C. | 2×10-25g | D. | 2×10-26g |
 、
、 、
、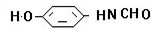 、
、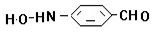 .
.