题目内容
8.2a L Fe2(SO4)3和(NH4)2SO4的混合液分成两等份,向其中一份加入bmol的BaCl2溶液,恰好使溶液中的SO42-完全沉淀:向另一等份加入足量NaOH固体可得到cmol Fe(OH)3沉淀,则原溶液中NH4+的物质的量浓度为______mol•L-1( )| A. | $\frac{2b-3c}{2a}$ | B. | $\frac{2b-3c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
分析 硫酸根离子和钡离子反应离子方程式为Ba2++SO42-=BaSO4↓,一份加入bmol的BaCl2溶液,根据离子方程式知,一份溶液中n(SO42-)=n(Ba2+)=bmol;
另一份溶液中加入足量固体可得到cmolFe(OH)3沉淀,根据Fe原子守恒得n[Fe2(SO4)3]=$\frac{1}{2}$n[Fe(OH)3]=$\frac{1}{2}$×cmol=0.5cmol,根据电荷守恒计算铵根离子浓度.
解答 解:硫酸根离子和钡离子反应离子方程式为Ba2++SO42-=BaSO4↓,一份加入bmol的BaCl2溶液,根据离子方程式知,一份溶液中n(SO42-)=n(Ba2+)=bmol;
另一份溶液中加入足量固体可得到cmolFe(OH)3沉淀,根据Fe原子守恒得n[Fe2(SO4)3]=$\frac{1}{2}$n[Fe(OH)3]=$\frac{1}{2}$×cmol=0.5cmol,
则原溶液中c(SO42-)=$\frac{bmol}{aL}$=$\frac{b}{a}$mol/L,c (Fe3+)=$\frac{0.5cmol×2}{aL}$=$\frac{c}{a}$mol/L,
溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+3c (Fe3+)=2c(SO42-),所以c(NH4+)=2c(SO42-)-3c (Fe3+)=2×$\frac{b}{a}$mol/L-3×$\frac{c}{a}$mol/L=$\frac{2b-3c}{a}$mol/L,
故选B.
点评 本题考查物质的量浓度有关计算,为高频考点,侧重考查学生分析判断及计算能力,明确各个物理量之间的关系是解本题关键,注意电荷守恒、原子守恒的灵活运用,题目难度不大.

练习册系列答案
相关题目
18.下列有关实验的叙述正确的是( )

| A. | 闻未知液体气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动 | |
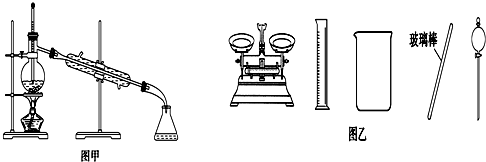
| B. | 将碘单质从碘的CCl4溶液中分离出来可用如图甲所示实验装置 | |
| C. | 用容量瓶配制好一定浓度的某溶液后,塞紧瓶塞并在容量瓶上贴上标签 | |
| D. | 配制500 mL 0.4 mol•L-1NaCl溶液,必要的仪器如图乙所示 |
19.易形成简单阴离子的元素是( )
| A. | O | B. | Mg | C. | Na | D. | He |
16.下列有关阿佛加德罗常数(NA)的说法错误的是( )
| A. | 0.5molH2O含有的原子数目为1.5NA | B. | 0.5molNH3含有的电子数目为4NA | ||
| C. | 28gCO含有的分子数目为NA | D. | 2NA个氯气分子的物质的量是2mol |
3.下列说法中,正确的是( )
| A. | 钠和氢气分别在氯气中燃烧,都产生白色烟雾 | |
| B. | 铜丝在氯气中燃烧,生成蓝色的氯化铜 | |
| C. | 液氯和氯水中滴入硝酸银溶液均会产生白色沉淀 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液后溶液呈红色 |
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA | |
| B. | CO2通过Na2O2使其增重5.6g时,反应中转移的电子数为0.4 NA | |
| C. | 0.2mol Fe与0.2 mol Cl2反应时失电子数为0.6NA | |
| D. | 常温常压下,29.8 g KCl与NaClO的固体混合物中阴离子的数目为0.4 NA |
20.在无土栽培中,需配制一定组成的植物营养液.已知某植物营养液的配方为0.6mol KCl、0.4mol K2SO4、0.20mol ZnSO4和1LH2O.若以KCl、K2SO4、ZnCl2和1LH2O为原料配得相同组成的营养液,需三种溶质的物质的量为( )
| A. | 0.20 mol、0.60 mol、0.20mol | B. | 0.30 mol、0.60 mol、0.10 mol | ||
| C. | 0.40 mol、0.60 mol、0.10 mol | D. | 0.20 mol、0.10mol、0.60 mol |