题目内容
16.下列有关阿佛加德罗常数(NA)的说法错误的是( )| A. | 0.5molH2O含有的原子数目为1.5NA | B. | 0.5molNH3含有的电子数目为4NA | ||
| C. | 28gCO含有的分子数目为NA | D. | 2NA个氯气分子的物质的量是2mol |
分析 A、水为三原子分子;
B、氨气中含10个电子;
C、求出CO的物质的量,然后根据分子个数N=nNA来计算;
D、物质的量n=$\frac{N}{{N}_{A}}$.
解答 解:A、水为三原子分子,故0.5mol水中含1.5NA个原子,故A正确;
B、氨气中含10个电子,故0.5mol氨气中含5NA个电子,故B错误;
C、28gCO的物质的量为1mol,故分子个数N=nNA=NA个,故C正确;
D、物质的量n=$\frac{N}{{N}_{A}}$=$\frac{2{N}_{A}}{{N}_{A}/mol}$=2mol,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
6.用NA表示阿伏加德常数,下列叙述中正确的是( )
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
7.在汽车加油站见到的油罐车上,所贴的危险化学品标志是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列原子半径由小到大排列顺序正确的是( )
| A. | O、S、Na | B. | Mg、P、Cl | C. | Cl、Na、F | D. | S、N、C |
11.用惰性电极电解足量的下列溶液,一段时间后停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
| A. | CuCl2( H2O) | B. | NaOH(Na2O) | C. | CuSO4( CuO) | D. | NaCl( NaOH) |
1.以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图为硫的价类图,例如d点可表示+6价的硫酸盐.下列说法错误的是( )
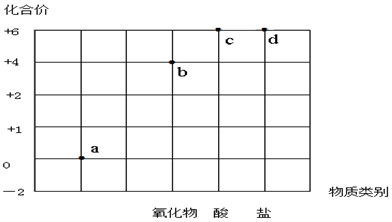

| A. | a点表示的物质所属的物质类别是单质 | |
| B. | b点表示的物质可以是SO2或SO3 | |
| C. | c点表示的化合物的浓溶液可作为干燥剂 | |
| D. | d点表示的可溶性物质能与BaCl2溶液发生反应 |
8.2a L Fe2(SO4)3和(NH4)2SO4的混合液分成两等份,向其中一份加入bmol的BaCl2溶液,恰好使溶液中的SO42-完全沉淀:向另一等份加入足量NaOH固体可得到cmol Fe(OH)3沉淀,则原溶液中NH4+的物质的量浓度为______mol•L-1( )
| A. | $\frac{2b-3c}{2a}$ | B. | $\frac{2b-3c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
11.I.如图1为实验室制乙烯的发生装置以及乙烯性质检验装置,其中利用乙醇分子内脱水的原理来制备乙烯,反应方程式如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.请回答下列问题:
实验操作和现象:

(1)图1中装置A的仪器①、②名称分别为温度计、圆底烧瓶_;
(2)实验过程中向B装置(溴水)中通入制备所得到的气体,溶液的颜色很快褪去,分析使B中溶液褪色的物质:
a.甲认为是C2H4.根据甲的判断,写出反应的化学方程式CH2=CH2+Br2→CH2BrCH2Br;该反应属于加成反应(填反应类型);
b.乙根据现象Ⅲ认为,在制取乙烯的实验中因温度过高使乙醇和浓硫酸反应生成少量的SO2,不能排除SO2的影响.根据乙的观点,写出在B中与SO2 反应使溶液褪色的反应方程式SO2+Br2+2H2O=2H2SO4+2HBr;
II.有人设计如图2装置进行实验以确认上述混合气体中有乙烯及二氧化硫.试回答下列问题:
(3)图中①②③④装置内,添加选择合适的试剂进行实验,以确认混合气体内的成分(按照仪器顺序从左到右填序号,可重复选择试剂):①A;②B;③A;④D;
A.品红溶液 B.氢氧化钠溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(4)根据装置内所选择的试剂,能说明二氧化硫气体存在的现象是装置①品红溶液褪色;使用装置②的目的是除去混合气体中的SO2,避免干扰实验结果;
(5)确定含有乙烯的现象是装置③中品红溶液不褪色,装置④高锰酸钾酸性溶液褪色.
实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |

(1)图1中装置A的仪器①、②名称分别为温度计、圆底烧瓶_;
(2)实验过程中向B装置(溴水)中通入制备所得到的气体,溶液的颜色很快褪去,分析使B中溶液褪色的物质:
a.甲认为是C2H4.根据甲的判断,写出反应的化学方程式CH2=CH2+Br2→CH2BrCH2Br;该反应属于加成反应(填反应类型);
b.乙根据现象Ⅲ认为,在制取乙烯的实验中因温度过高使乙醇和浓硫酸反应生成少量的SO2,不能排除SO2的影响.根据乙的观点,写出在B中与SO2 反应使溶液褪色的反应方程式SO2+Br2+2H2O=2H2SO4+2HBr;
II.有人设计如图2装置进行实验以确认上述混合气体中有乙烯及二氧化硫.试回答下列问题:
(3)图中①②③④装置内,添加选择合适的试剂进行实验,以确认混合气体内的成分(按照仪器顺序从左到右填序号,可重复选择试剂):①A;②B;③A;④D;
A.品红溶液 B.氢氧化钠溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(4)根据装置内所选择的试剂,能说明二氧化硫气体存在的现象是装置①品红溶液褪色;使用装置②的目的是除去混合气体中的SO2,避免干扰实验结果;
(5)确定含有乙烯的现象是装置③中品红溶液不褪色,装置④高锰酸钾酸性溶液褪色.