题目内容
18.下列有关实验的叙述正确的是( )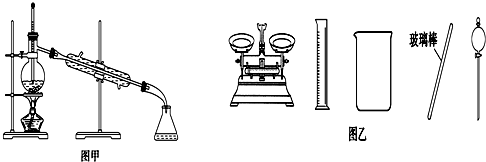
| A. | 闻未知液体气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动 | |
| B. | 将碘单质从碘的CCl4溶液中分离出来可用如图甲所示实验装置 | |
| C. | 用容量瓶配制好一定浓度的某溶液后,塞紧瓶塞并在容量瓶上贴上标签 | |
| D. | 配制500 mL 0.4 mol•L-1NaCl溶液,必要的仪器如图乙所示 |
分析 A.闻气味时应避免中毒;
B.温度计位置错误;
C.容量瓶不能用于保存溶液;
D.配制溶液需要容量瓶.
解答 解:A.闻气味时应避免中毒,应用手轻轻扇动,使少量气体飘进鼻孔,故A正确;
B.温度计位置错误,应位于蒸馏烧瓶的支管口,故B错误;
C.容量瓶不能用于保存溶液,应转移到试剂瓶中,故C错误;
D.配制溶液需要容量瓶,不需要分液漏斗,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、溶液配制为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
8.在电子工业中利用镁制取硅的反应为2Mg+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Si,同时会发生副反应:2Mg+Si$\frac{\underline{\;\;△\;\;}}{\;}$Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易自燃的气体.图是进行Mg与SiO2反应的实验装置.试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有不良影响,实验中应通入X气体作为保护气.在A、B、C三种仪器中反应开始前的试剂分别是:A①,B⑥,C②(填序号).
①稀硫酸 ②浓硫酸 ③稀盐酸 ④石灰石 ⑤纯碱 ⑥锌粒
(2)实验开始时,必须先通入X气体,再加热反应物,其理由是防止加热条件下H2与空气混合爆炸;
当反应引发后,移走酒精灯,反应能继续进行,其原因是Mg与SiO2的反应是放热反应.
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因用化学方程式表示为:①Mg2Si+4HCl=2MgCl2+SiH4↑,②SiH4+2O2═SiO2+2H2O.
(4)这样制得的硅会混有杂质(如SiO2等)而称粗硅,有人设计了如下流程进行提纯
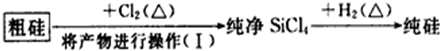
相关物质的性质如下:
操作(I)的名称是蒸馏.涉及的化学反应方程式有:Si+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4;SiCl4+2H2$\frac{\underline{\;\;△\;\;}}{\;}$Si+4HCl.

(1)由于O2和H2O(g)的存在对该实验有不良影响,实验中应通入X气体作为保护气.在A、B、C三种仪器中反应开始前的试剂分别是:A①,B⑥,C②(填序号).
①稀硫酸 ②浓硫酸 ③稀盐酸 ④石灰石 ⑤纯碱 ⑥锌粒
(2)实验开始时,必须先通入X气体,再加热反应物,其理由是防止加热条件下H2与空气混合爆炸;
当反应引发后,移走酒精灯,反应能继续进行,其原因是Mg与SiO2的反应是放热反应.
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因用化学方程式表示为:①Mg2Si+4HCl=2MgCl2+SiH4↑,②SiH4+2O2═SiO2+2H2O.
(4)这样制得的硅会混有杂质(如SiO2等)而称粗硅,有人设计了如下流程进行提纯
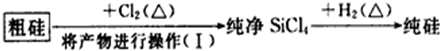
相关物质的性质如下:
| 物质 | Si | SiCl4 |
| 沸点/℃ | 2355 | 57.6 |
9. 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
以下是实验数据记录表:
(1)请根据图(滴定管局部)读出第2次实验的末读数,填充上表中的两个空格.
(2)计算待测盐酸溶液浓度.
 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.以下是实验数据记录表:
| 实验序号 | 待测盐酸溶液体积(mL) | 滴定管读数 | 消耗标准NaOH溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
(2)计算待测盐酸溶液浓度.
6.用NA表示阿伏加德常数,下列叙述中正确的是( )
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
13.一定温度下,在三个体积都为2L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
回答下列问题:
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量小,说明反应为放热反应,△H小于0.
(2)容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(3)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
(1)反应的△H<O (填“>”或“<”);判断的理由是投料量相同时,温度高的容器,平衡时二甲醚的物质的量小,说明反应为放热反应,△H小于0.
(2)容器I到达平衡所需的时间为20s,反应速率v(CH3OH)为0.004mol/(L•s).390℃时该反应的平衡常数K1=4(填数值).
(3)容器II达平衡时,压强是容器I的两倍,CH3OH的体积分数和容器I中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OH(g)的体积分数为20%.
(4)390℃,若向3L容器中充入0.9mol CH3OH(g),0.6mol CH3OCH3(g)和0.3molH2O(g),则起始时该反应速率V正>V逆.(填“>”“<”或“=”)
3.下列说法正确的是( )
| A. | 已知X、Y元素同周期,且电负性X>Y,则第一电离能X大于Y | |
| B. | 分子中键能越大,键长越短,则分子越稳定,熔沸点越高 | |
| C. | N-H键键能的含义是拆开约6.02×1023个N-H键所吸收的能量 | |
| D. | H2O中每个O原子结合2个H原子的根本原因是共价键具有方向性 |
10.对已达到化学平衡的反应2A(g)+3B(s)?2C(g),增大压强时,对反应产生的影响是( )
| A. | 正反应速率增大,逆反应速率减小,平衡向正向移动 | |
| B. | 逆反应速率增大,正反应速率减小,平衡逆向移动 | |
| C. | 正、逆反应速率都增大,平衡不移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
7.在汽车加油站见到的油罐车上,所贴的危险化学品标志是( )
| A. |  | B. |  | C. |  | D. |  |
8.2a L Fe2(SO4)3和(NH4)2SO4的混合液分成两等份,向其中一份加入bmol的BaCl2溶液,恰好使溶液中的SO42-完全沉淀:向另一等份加入足量NaOH固体可得到cmol Fe(OH)3沉淀,则原溶液中NH4+的物质的量浓度为______mol•L-1( )
| A. | $\frac{2b-3c}{2a}$ | B. | $\frac{2b-3c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |