题目内容
13.设NA表示阿伏加德罗常数,下列说法中不正确的是( )| A. | 5.85gNaCl晶体中含有0.1 NA 个Na+ | |
| B. | 1molFeCl3 完全水解转化为Fe(OH)3胶体后能生成NA个胶体粒子 | |
| C. | 过量的Zn与含1molH2SO4的稀H2SO4完全反应,转移的电子数一定为2NA | |
| D. | 一定量的Fe 与含1molHNO3的稀HNO3恰好完全反应,被还原的氮原子数小于NA |
分析 A、求出氯化钠的物质的量,然后根据氯化钠由一个钠离子和一个氯离子来分析;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、锌与稀硫酸反应时,是和稀硫酸中的氢离子反应;
D、铁和硝酸反应时,硝酸既做氧化剂又做酸.
解答 解:A、5.85g氯化钠的物质的量为0.1mol,而氯化钠由一个钠离子和一个氯离子,故0.1mol氯化钠中含0.1NA个钠离子,故A正确;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于NA个,故B错误;
C、锌与稀硫酸反应时,是和稀硫酸中的氢离子反应,将氢离子还原为0价,而硫酸溶液中的氢离子为2mol,故转移的电子数为2NA个,故C正确;
D、铁和硝酸反应时,硝酸既做氧化剂又做酸,故做氧化剂的硝酸小于1mol,即被还原的氮原子小于NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
3. 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.
已知:①2CO(g)+O2(g)=2CO2(g)△H1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H,△H=△H2-△H1-2△H3,这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是减少二氧化碳排放,缓解温室效应.
(2)氨气是重要化工原料,在国民经济中占重要地位.
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
实验测得起始、平衡时的有关数据如表所示:
下列判断正确的是BC.
A.N2的转化率:Ⅱ>I>Ⅲ
B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>Ⅰ
D.平衡常数:Ⅲ>Ⅱ>Ⅰ
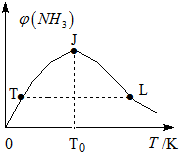
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
曲线TJ段变化主要原因是平衡之前,反应向生成氨方向进行,JL段变化的主要原因是该正反应是放热反应,平衡之后,升高温度,平衡向逆方向移动,促进氨分解,氨的体积分数减小,氨气正反应速率:T点小于小于L点(填:大于、小于或等于).
③在2L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
在该条件下,前5分钟H2平均反应速率为0.15mol/(L•min).
④常温下,在V mL的a mol•L-1稀硫酸溶液中滴加b mol•L-1稀氨水V mL恰好使混合溶液呈中性.此时,一水合氨的电离常数Kb=$\frac{2a}{(b-2a)×1{0}^{7}}$(用含a、b代数式表示).
(3)氢气直接作燃料电池的理论输出电压为1.2V,能量密度E=$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$=32.2kW•h•kg-1(列式计算,精确到小数点后一位.提示:能量密度=电池输出电能/燃料质量,1kW•h=3.6×106J,常用单位为kW•h•kg-1).
 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.已知:①2CO(g)+O2(g)=2CO2(g)△H1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H,△H=△H2-△H1-2△H3,这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是减少二氧化碳排放,缓解温室效应.
(2)氨气是重要化工原料,在国民经济中占重要地位.
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
A.N2的转化率:Ⅱ>I>Ⅲ
B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>Ⅰ
D.平衡常数:Ⅲ>Ⅱ>Ⅰ
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
曲线TJ段变化主要原因是平衡之前,反应向生成氨方向进行,JL段变化的主要原因是该正反应是放热反应,平衡之后,升高温度,平衡向逆方向移动,促进氨分解,氨的体积分数减小,氨气正反应速率:T点小于小于L点(填:大于、小于或等于).
③在2L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
④常温下,在V mL的a mol•L-1稀硫酸溶液中滴加b mol•L-1稀氨水V mL恰好使混合溶液呈中性.此时,一水合氨的电离常数Kb=$\frac{2a}{(b-2a)×1{0}^{7}}$(用含a、b代数式表示).
(3)氢气直接作燃料电池的理论输出电压为1.2V,能量密度E=$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$=32.2kW•h•kg-1(列式计算,精确到小数点后一位.提示:能量密度=电池输出电能/燃料质量,1kW•h=3.6×106J,常用单位为kW•h•kg-1).
4.下列氧化还原反应中,水作为氧化剂的是( )
| A. | C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | Cl2+SO2+H2O=H2SO4+2HCl | D. | 2F2+2H2O=4HF+O2 |
1.向含有amol FeBr2的溶液中,通入x mol Cl2,下列各项为通Cl2过程中,溶液发生反应的离子方程式,其中正确的是( )
| A. | x=0.6a 2Fe2++Cl2=2Fe3++2Cl- | |
| B. | x=a 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| C. | x=0.4a 2Br-+Cl2=Br2+2Cl- | |
| D. | x=2a 2Fe2++6Br-+4Cl2=3Br2+2Fe3++8Cl- |
18.现有反应CO(g)+H2O(g)?CO2(g)+H2(g);△H<0,在850℃时K=1.在一个体积可变的密闭容器中充入 1molCO、3mol H2O、1mol CO2、和xmol H2,下列说法中不正确的是( )
| A. | 900℃时,该反应的平衡常数K<1 | |
| B. | 850℃时,若x=5,则起始时反应向逆反应方向进行 | |
| C. | 850℃时,若要使上述反应开始时向正反应方向进行,则x应满足0≤x<3 | |
| D. | 850℃时,已知x>3,则随着x的增大,H2的转化率一定始终增大 |
5.用下列装置进行的实验,能达到相应实验目的是( )
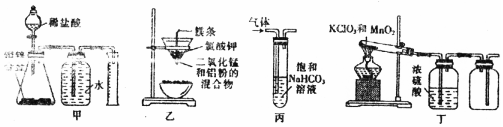

| A. | 装置甲:测定合金中Zn的含量 | B. | 装置乙:制取金属锰 | ||
| C. | 装置丙:洗气除去SO2中的CO2 | D. | 装置丁:实验室制取O2 |
3.下列实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 证明氧化性:H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| B | 鉴别溴蒸气和NO2 | 分别通入硝酸银溶液中,产生淡黄色沉淀的是溴蒸汽 |
| C | 证明盐类水解是吸热反应 | 在醋酸钠溶液中滴入酚酞试液,加热后红色加深 |
| D | 证明难溶物存在沉淀溶解平衡 | 往黄色固体难溶物PbI2加水中振荡,静置取上层清液加入 NaI固体产生黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
 向100mL 3mol•L-1硫酸铝铵【NH4Al(SO4)2】溶液中逐滴加入1mol•L-1Ba(OH)2溶液.
向100mL 3mol•L-1硫酸铝铵【NH4Al(SO4)2】溶液中逐滴加入1mol•L-1Ba(OH)2溶液.