题目内容
8. 向100mL 3mol•L-1硫酸铝铵【NH4Al(SO4)2】溶液中逐滴加入1mol•L-1Ba(OH)2溶液.
向100mL 3mol•L-1硫酸铝铵【NH4Al(SO4)2】溶液中逐滴加入1mol•L-1Ba(OH)2溶液.(1)写出当刚好出现沉淀物质的量总量的最大值时的离子方程式(用一个式子表示):Al3++2SO42-+NH4++2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3•H2O.
(2)随着Ba(OH)2溶液体积的变化,沉淀总物质的量的变化如图所示(Y代表沉淀总物质的量/mol;X代表Ba(OH)2溶液体积/mL).写出B点和C点所对应的Ba(OH)2溶液的体积:B600mL,C750mL.
分析 100mL3mol•L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.3mol.溶液含有NH4+0.3mol,Al3+0.3mol,SO42-0.6mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.9molOH-,即加入0.45molBa(OH)2,加入的Ba2+为0.45mol,SO42-未完全沉淀,此时溶液含有硫酸铵(开始到A);
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.6molBa(OH)2,加入1.2molOH-,Al3+反应掉0.9molOH-,生成Al(OH)30.3mol,剩余0.3molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液(A到B);
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.3molAl(OH)3完全溶解,需再加入0.15molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(B到C).
解答 解:(1)100mL3mol•L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.3mol.溶液含有NH4+0.3mol,Al3+0.3mol,SO42-0.6mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.9molOH-,即加入0.45molBa(OH)2,加入的Ba2+为0.45mol,SO42-未完全沉淀,此时溶液含有硫酸铵(开始到A);
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.6molBa(OH)2,加入1.2molOH-,Al3+反应掉0.9molOH-,生成Al(OH)30.3mol,剩余0.3molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,所以生成沉淀的总物质的量为最大值时的离子方程式:Al3++2SO42-+NH4++2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3•H2O,
故答案为:Al3++2SO42-+NH4++2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3•H2O;
(2)开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.9molOH-,即加入0.45molBa(OH)2,加入的Ba2+为0.45mol,SO42-未完全沉淀,此时溶液含有硫酸铵(开始到A),再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.6molBa(OH)2,加入1.2molOH-,Al3+反应掉0.9molOH-,生成Al(OH)30.3mol,剩余0.3molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液,故当到达B点时,加入1mol•L-1 Ba(OH)2溶液的体积是:$\frac{0.6mol}{1mol/L}$=0.6L=600mL,继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.3molAl(OH)3完全溶解,需再加入0.15molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液.(B到C),所以到达C点时加入氢氧化钡的体积是:$\frac{0.75mol}{1mol/L}$=0.75L=750mL,
故答案为:600mL;750mL.
点评 本题考查铝化合物的性质、离子反应计算,难度比较大,清楚整个反应过程是解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应.

| A. | 化学研究会造成严重的环境污染,危害人们的生活 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用大量木材作燃料可以缓解当前能源不足问题 | |
| D. | 对于常见的大多数金属,其金属活动性越强,冶炼就越困难 |
| A. | CO和H2 | B. | C6H12O6 | C. | CH2O2 | D. | C2H5OH |
| A. | 5.85gNaCl晶体中含有0.1 NA 个Na+ | |
| B. | 1molFeCl3 完全水解转化为Fe(OH)3胶体后能生成NA个胶体粒子 | |
| C. | 过量的Zn与含1molH2SO4的稀H2SO4完全反应,转移的电子数一定为2NA | |
| D. | 一定量的Fe 与含1molHNO3的稀HNO3恰好完全反应,被还原的氮原子数小于NA |
 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:| T(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的正反应为放(填“吸”或“放”)热反应.
(2)判断该反应到达平衡的依据是BCF(填字母代号)
A.容器内压强不变 B.混合气体中[CO]不变
C.V正(H2)=V逆(H2O) D.[CO]=[CO2]
E.K值不变 F.[CO]/[H2O]不变
(3)若容器的体积固定为10L,在容器中通入一定量的CO和H2O(g),并在T1℃时发生反应.
①CO和H2O的浓度变化如图所示,则在0-4min内正反应的平均反应速率为v(CO)0.03mol•L-1•min-1.
②此反应的温度等于850℃(填“大于”,“小于”或“等于”).
③图中6-7min浓度发生变化的原因可能是BE
A.只充入H2O(g) B.只升高温度
C.只使用催化剂 D.只充入惰性气体
E.只充入CO2
(4)850℃时,起始浓度[CO]=a mol/L,[H2O]=b mol/L,平衡时[H2]=c mol/L.则:
①a、b、c之间的关系是c2=(a-c)(b-c)或c=$\frac{ab}{a+b}$.
②当a=b时,a=2c.
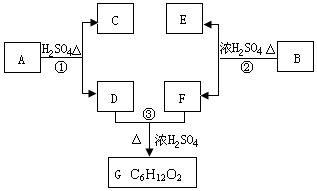 A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:
A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示: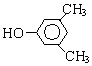 或
或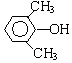 或
或 (写出一种即可).
(写出一种即可). 或
或
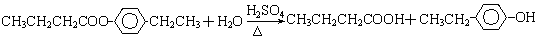 .①反应的反应类型取代反应
.①反应的反应类型取代反应 或
或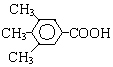 .
.