题目内容
1.向含有amol FeBr2的溶液中,通入x mol Cl2,下列各项为通Cl2过程中,溶液发生反应的离子方程式,其中正确的是( )| A. | x=0.6a 2Fe2++Cl2=2Fe3++2Cl- | |
| B. | x=a 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| C. | x=0.4a 2Br-+Cl2=Br2+2Cl- | |
| D. | x=2a 2Fe2++6Br-+4Cl2=3Br2+2Fe3++8Cl- |
分析 二价铁离子还原性强于溴离子,氯气先氧化二价铁离子,再氧化溴离子,由此分析解答.
解答 解:由于还原性:Fe2+>Br-,通入Cl2,依次发生2Fe2++Cl2=2Fe3++2Cl-,2Br-+Cl2=Br2+2Cl-,
当n(Cl2):n(FeBr2)≤$\frac{1}{2}$时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥$\frac{3}{2}$时,Fe2+和Br-被完全氧化,介于二者之间时,
Fe2+被完全氧化,Br-被部分氧化,则
A.x=0.6a,n(Cl2):n(FeBr2)介于$\frac{1}{2}$~$\frac{3}{2}$,Fe2+被完全氧化,Br-被部分氧化,故A错误;
B.x=a,n(Cl2):n(FeBr2)介于$\frac{1}{2}$~$\frac{3}{2}$,Fe2+被完全氧化,amolFe2+被氧化消耗0.5amolCl2,剩余0.5amolCl2可与amolBr-发生氧化还原反应,则反应的离子方程式为2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-,故B正确;
C.x=0.4a,n(Cl2):n(FeBr2)=0.4<$\frac{1}{2}$,只氧化Fe2+,故C错误;
D.x=2a,Fe2+和Br-恰好被完全氧化,反应的离子方程式为2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-,故D错误.
故选B.
点评 本题考查氧化还原反应,题目难度较大,本题注意把握物质的还原性强弱,此为解答该题的关键,答题时注意氧化剂和还原剂物质的量之间的关系,此为易错点.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
9.在强酸溶液中,下列各组离子能够大量共存的是( )
| A. | Mg2+、Ca2+、HCO3-、Cl- | B. | Fe2+、Ca2+、Cl-、NO3- | ||
| C. | K+、Fe2+、SO42-、Br- | D. | Na+、K+、SO42-、AlO2- |
16.将a g下列选项中的物质在足量的氧气中完全燃烧,再将产生的气体通过足量的Na2O2固体,充分反应后,固体增加的质量大于a g的是( )
| A. | CO和H2 | B. | C6H12O6 | C. | CH2O2 | D. | C2H5OH |
6.下列各组离子一定能大量共存的是( )
| A. | 在强碱溶液中:Na+、K+、CO32-、NO3- | |
| B. | 在pOH=2的溶液中:NH4+、Na+、SO42-、AlO2- | |
| C. | 在pH=1的溶液中:K+、Ag+、Mg2+、Fe2+ | |
| D. | 水电离出来的c(H+)=1×10-13 mol•L-1的溶液:K+、HCO3-、Br-、Ba2+ |
13.设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A. | 5.85gNaCl晶体中含有0.1 NA 个Na+ | |
| B. | 1molFeCl3 完全水解转化为Fe(OH)3胶体后能生成NA个胶体粒子 | |
| C. | 过量的Zn与含1molH2SO4的稀H2SO4完全反应,转移的电子数一定为2NA | |
| D. | 一定量的Fe 与含1molHNO3的稀HNO3恰好完全反应,被还原的氮原子数小于NA |

 .
.

 扑热息痛的结构简式为
扑热息痛的结构简式为


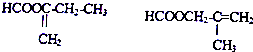
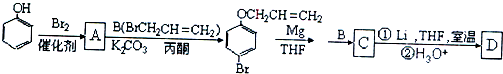
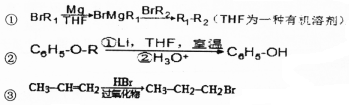
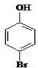 、
、 .
. 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境. 的有机反应类型取代反应.
的有机反应类型取代反应. .
.
 .
.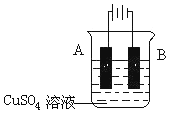 钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.