题目内容
6.W、X、Y、Z是原子序数依次增大的四种短周期元素.W的气态氢化物能使紫色石蕊溶液变蓝,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,W、X、Y、Z的最外层电子数之和为16.(1)W单质的电子式是
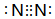 .
.(2)请用化学用语解释W的气态氢化物能使紫色石蕊溶液变蓝的原因:NH3+H2O
 NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.(3)已知As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是第四周期 第VA族.
(4)W的最高价氧化物的水化物与Y的氢氧化物发生反应的离子方程式是3H++Al(OH)3═Al3++3H2O.
(5)X与Z的单质之间发生反应的化学方程式是2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl.
(6)已知Q与Z是位于相邻周期的同主族元素.某温度下,两种元素的气态单质与H2发生化合反应生成气态氢化物的平衡常数分别为KQ=5.6×107,KZ=9.7×1012.Q的元素符号是Br,理由是由KQ<KZ可知Q的气态氢化物的稳定性弱于Z,故Q的非金属性弱于Z.
分析 W、X、Y、Z是原子序数依次增大的四种短周期元素.W的气态氢化物能使紫色石蕊溶液变蓝,则W为N元素,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,应是氢氧化铝与强酸、强碱之间的反应,可以推断X为Na、Y为Al.由于W、X、Y、Z的最外层电子数之和为16,可知Z原子最外层电子数为16-5-1-3=7,由原子序数知Z处于第三周期,故Z为Cl,据此解答.
解答 解:W、X、Y、Z是原子序数依次增大的四种短周期元素.W的气态氢化物能使紫色石蕊溶液变蓝,则W为N元素,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,应是氢氧化铝与强酸、强碱之间的反应,可以推断X为Na、Y为Al.由于W、X、Y、Z的最外层电子数之和为16,可知Z原子最外层电子数为16-5-1-3=7,由原子序数知Z处于第三周期,故Z为Cl.
(1)W单质为N2,其电子式是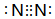 ,故答案为:
,故答案为: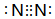 ;
;
(2)W的气态氢化物能使紫色石蕊溶液变蓝的原因:NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-,
NH4++OH-,
故答案为:NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-;
NH4++OH-;
(3)As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是:第四周期 第VA族,
故答案为:第四周期 第VA族;
(4)W的最高价氧化物的水化物为HNO3,Y的氢氧化物为Al(OH)3,二者发生反应的离子方程式是:3H++Al(OH)3═Al3++3H2O,
故答案为:3H++Al(OH)3═Al3++3H2O;
(5)X与Z的单质之间发生的反应是钠在氯气中燃烧生成氯化钠,反应的化学方程式是:2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl,
故答案为:2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl;
(6)已知Q与Z(Cl))是位于相邻周期的同主族元素,则Q为Br,由KQ<KZ可知Q的气态氢化物的稳定性弱于Z,故Q的非金属性弱于Z,
故答案为:Br;由KQ<KZ可知Q的气态氢化物的稳定性弱于Z,故Q的非金属性弱于Z.
点评 本题采取元素推断形式,考查学生对原子结构、元素周期律、元素周期表、元素化合物以及常用化学用语等知识的掌握和应用能力,关键是根据W氢化物性质入手进行推断.

 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=-(b-2c-$\frac{a}{2}$)kJ•mol-1.
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验的温度:T2<T1
B.实验①前20min的平均反应速率 v(O2)=7×10-5 mol•L-1 min-1
C.实验②比实验①所用的催化剂催化效率高.
 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.(1)H2或CO可以催化还原NO以达到消除污染的目的.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1 kJ•mol-1.
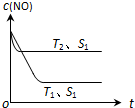
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.图表示在其他条件不变时,反应:2CO(g)+2NO(g)?2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H<0 (填“>”或“<”).
②若催化剂的表面积S1>S2,在右图中画出c (NO) 在T1、S2条件下达到平衡过程中的变化曲线.
(3)在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c (NO)(×10-3 mol•L-1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
| c (CO)(×10-3 mol•L-1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
②计算前2s内的平均反应速率v (N2);
③计算达到平衡时NO的转化率.
| A. | 10g H2 | B. | 2molCl2 | C. | 1.5NACO2 | D. | 22.4LO2(标准状况) |
| A. | 该氯原子的相对原子质量为$\frac{a}{b}$ | |
| B. | m g该氯原子的物质的量为$\frac{m}{a{N}_{A}}$mol | |
| C. | 该氯原子的摩尔质量为aNAg | |
| D. | a g该氯原子所含的电子数为17 mol |
| A. | 鉴别胶体与浊液(丁达尔效应) | B. | 高压除尘(电泳现象) | ||
| C. | 河海交汇处可沉积沙洲(聚沉) | D. | 喷雾剂的应用(布朗运动) |

| A. | 若从a点到c点,可采用在水中加入酸的方法 | |
| B. | b点对应的醋酸中由水电离的c(H+)=10-6mol•L-1 | |
| C. | T℃时,0.05 mol•L-1的Ba(OH)2溶液的pH=11 | |
| D. | c点对应溶液的Kw大于d点对应溶液的Kw |
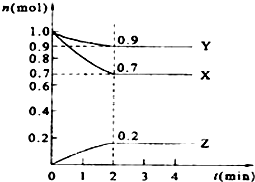 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.