题目内容
14. 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.(1)H2或CO可以催化还原NO以达到消除污染的目的.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1 kJ•mol-1.
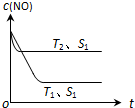
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.图表示在其他条件不变时,反应:2CO(g)+2NO(g)?2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H<0 (填“>”或“<”).
②若催化剂的表面积S1>S2,在右图中画出c (NO) 在T1、S2条件下达到平衡过程中的变化曲线.
(3)在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c (NO)(×10-3 mol•L-1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
| c (CO)(×10-3 mol•L-1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
②计算前2s内的平均反应速率v (N2);
③计算达到平衡时NO的转化率.
分析 (1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
根据盖斯定律,②-①可得:2H2(g)+2NO(g)=N2(g)+2H2O(l);
(2)①根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图;
(3)反应为:2CO(g)+2NO(g)?2CO2(g)+N2(g),
①结合图表数据计算得到前2s内的△c (CO2);
②利用图表数据和化学平衡三行计算分别列式计算得到前2s内的平均反应速率v (N2);
③3s反应达到平衡状态,NO物质的量浓度1×10-3 mol•L-1 变化为0.1×10-3 mol•L-1,转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
根据盖斯定律,②-①可得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1 kJ•mol-1,
故答案为:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=-752.1 kJ•mol-1;
(2)①温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为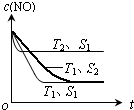 ,故答案为:
,故答案为: ;
;
(3)2CO(g)+2NO(g)?2CO2(g)+N2(g)
起始浓度(×10-3 mol•L-1) 3.00 1.00 0 0
2s末浓度(×10-3 mol•L-1) 2.20 0.20 0.80 0.40
2s变化浓度(×10-3 mol•L-1)0.80 0.80 0.80 0.40
平衡浓度(×10-3 mol•L-1) 2.10 0.10 0.90 0.45
①△c (CO2)=0.80 mol•L-1,答:前2s内的△c (CO2)为0.80 mol•L-1 ;
②v (N2)=$\frac{0.40molL}{2s}$=0.20 mol•L-1•s-1,
答:0.20 mol•L-1•s-1 ;
③依据上述三行计算得到平衡时NO的转化率为$\frac{1.00×1{0}^{-3}-0.1×1{0}^{-3}}{1.00×1{0}^{-3}}$×100%=90%,
答:达到平衡时NO的转化率为90%.
点评 本题主要考查化学反应速率、影响化学平衡的因素、化学平衡图象以及热化学方程式的书写等,注意根据“先拐先平数值大”原则判断温度高低是关键,作图时注意到达平衡的时间与平衡时NO的浓度,难度不大.

(1)Li3N晶体中氮以N3-存在,基态N3-的核外电子的轨道表示式为
 .
.(2)N≡N的键能为942kJ/mol,N-N单键的键能为247kJ/mol,计算说明N2中的π键比σ键稳定(填“σ”“π”).
(3)根据表数据,写出氮气与氢气反应生成氨气的热化学方程式N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1.
| 化学键 | N-N | N=N | N≡N | N-H | H-H |
| 键能/kJ•mol-1 | 159 | 418 | 946 | 391 | 436 |
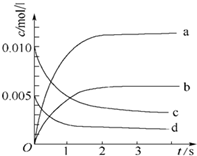 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内 该反应的平均速率v=1.5×10-3mol•L-1•s-1
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v正(NO)=2v逆(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
(5)平衡时NO的转化率为:65%.
NaBr+H2SO4═HBr+NaHSO4 ①
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.蒸发皿
(2)溴代烃的水溶性大于(填“大于”、“等于”或“小于”)醇.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是abc.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大.
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |
| A. | 分散质直径大小 | B. | 分散质粒子是否带电 | ||
| C. | 是否稳定 | D. | 是否有丁达尔现象 |
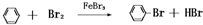 .
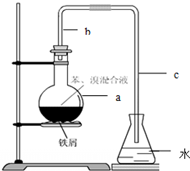
.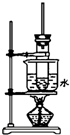 如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).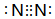 .
. NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.