题目内容
17. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=-(b-2c-$\frac{a}{2}$)kJ•mol-1.
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验的温度:T2<T1
B.实验①前20min的平均反应速率 v(O2)=7×10-5 mol•L-1 min-1
C.实验②比实验①所用的催化剂催化效率高.
分析 (1)炭粉在高温条件下还原CuO易生成Cu;
(2)根据盖斯定律结合热化学方程式的书写方法来书写;
(3)在电解池的阳极发生失电子得还原反应;
(4)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(5)A、根据温度对化学平衡移动的影响知识来回答;
B、根据反应速率v=$\frac{△c}{△t}$来计算水蒸气的反应速率,速率之比等于化学方程式计量数之比;
C、催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快.
解答 解:(1)炭粉在高温条件下还原CuO易生成Cu,反应不易控制,
故答案为:Cu;
(2)已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-akJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-bkJ•mol-1,
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g)
该反应可以是②-③×2-$\frac{1}{2}$×①,反应的焓变是:△H=-(b-2c-$\frac{a}{2}$)KJ/mol,
故答案为:-(b-2c-$\frac{a}{2}$);
(3)在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,
故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
(4)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O,
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
(5)A、实验温度越高达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高所以T2>T1,故A错误;
B、实验①前20min的平均反应速率 v(H2O)=$\frac{△c}{△t}$=$\frac{0.05mol/L-0.0486mol/L}{20min}$=7×10-5 mol•L-1 min-1,v(O2)=$\frac{1}{2}$ v(H2O)=3.5×10-5 mol•L-1 min-1,故B错误;
C、①②化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,②中水蒸气的浓度变化比①快,实验②比实验①所用的催化剂催化效率高,故C正确;
故答案为:C.
点评 本题是一道有关热化学、电化学以及化学反应速率和反应限度的综合题,考查角度广,注意基础知识的熟练掌握,题目难度中等.

| A. | 4.4 | B. | 5.6 | C. | 6.7 | D. | 8.4 |
(1)Li3N晶体中氮以N3-存在,基态N3-的核外电子的轨道表示式为
 .
.(2)N≡N的键能为942kJ/mol,N-N单键的键能为247kJ/mol,计算说明N2中的π键比σ键稳定(填“σ”“π”).
(3)根据表数据,写出氮气与氢气反应生成氨气的热化学方程式N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1.
| 化学键 | N-N | N=N | N≡N | N-H | H-H |
| 键能/kJ•mol-1 | 159 | 418 | 946 | 391 | 436 |
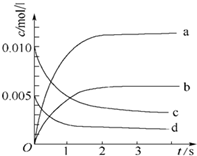 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内 该反应的平均速率v=1.5×10-3mol•L-1•s-1
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v正(NO)=2v逆(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
(5)平衡时NO的转化率为:65%.
NaBr+H2SO4═HBr+NaHSO4 ①
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.蒸发皿
(2)溴代烃的水溶性大于(填“大于”、“等于”或“小于”)醇.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是abc.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大.
| A. | 物质发生化学变化一定伴随着能量变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的 |
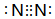 .
. NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.