题目内容
11.下列物质中,所含分子数最少的是(NA表示阿伏加德罗常数)( )| A. | 10g H2 | B. | 2molCl2 | C. | 1.5NACO2 | D. | 22.4LO2(标准状况) |
分析 根据N=nNA可知,物质含有的物质的量越大,含有的分子数越大,故所含分子数最少,说明该物质的物质的量最小;先将各选项的物理量转化成物质的量,然后比较物质的量大小即可.
解答 解:A.10g H2的物质的量为5mol,含分子数5NA;
B.2molCl2,含分子数2NA;
C.1.5NACO2;
D.22.4LO2(标准状况)的物质的量为1mol,含分子数NA;
所以含有分子数最少的是D,
故选D.
点评 本题考查阿伏加德罗常数的有关计算,题目难度不大,解题根据是掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
2.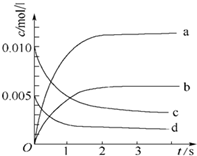 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)800℃时,反应达到平衡时,NO的物质的量浓度是0.0035mol/L.
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内 该反应的平均速率v=1.5×10-3mol•L-1•s-1
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v正(NO)=2v逆(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
(5)平衡时NO的转化率为:65%.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b.用O2表示从0~2s内 该反应的平均速率v=1.5×10-3mol•L-1•s-1
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v正(NO)=2v逆(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
(5)平衡时NO的转化率为:65%.
16.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在常温常压下11.2 L氢气所含的原子数目为NA | |
| B. | 18 g水所含的氢原子数目为NA | |
| C. | 2.3 g金属钠转化为Na2O和Na2O2的混合物时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数为1 NA |
3.天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体.下列有关说法不正确的是( )
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |
1.用NA表示阿伏伽德罗常数,下列说法不正确的是( )
| A. | 1.6g 由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | Na2O和Na2O2中阴阳离子个数比都为1:2 | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L H2O中含有的分子的数目为0.5 NA |
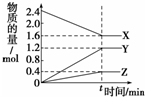
 如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).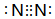 .
. NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.