题目内容
16.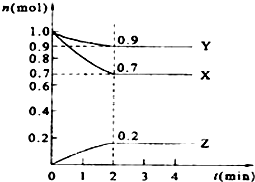 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.(1)反应物是X、Y,生成物是Z
(2)X的转化率是30%
(3)由图中所给数据进行分析,该反应的化学方程为3X+Y?2Z.
分析 (1)根据图象知,随着反应进行,X、Y的物质的量减少而Z物质的量增大,说明X、Y是反应物而Z是生成物;
(2)根据转化率=$\frac{转化量}{起始量}$×100%计算;
(3)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式.
解答 解:(1)根据图象知,随着反应进行,X、Y的物质的量减少而Z物质的量增大,说明X、Y是反应物而Z是生成物;
故答案为:X、Y; Z
(2)从图表可知X到平衡从1mol变为0.7mol,则转化率=$\frac{1mol-0.7mol}{1mol}$×100%=30%;
故答案为:30%
(3)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.1mol:0.3mol:0.2mol=1:3:2,则反应的化学方程式为3X+Y?2Z
故答案为:3X+Y?2Z
点评 本题考查化学平衡图象分析题目,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
1.下列类比关系正确的是( )
| A. | Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2 | |
| B. | Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3 | |
| C. | 钠与氧气在不同条件下反应会生成两种不同的氧化物,则Li与氧气反应也能生成Li2O或Li2O2 | |
| D. | Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应 |
7.已知lg2=0.3,KSP[Cr(OH)3]=6.4×10-31.某工厂进行污水处理时,要使污水中的Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5时,可以认为Cr3+沉淀完全,溶液的pH至少为( )
| A. | 4.4 | B. | 5.6 | C. | 6.7 | D. | 8.4 |
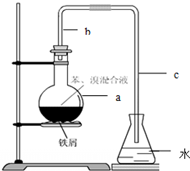
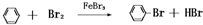 .
.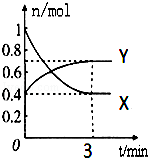 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.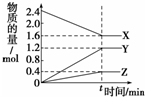
 .
. .
. NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.