题目内容
16.加热金属Cu与浓硫酸反应,得到SO2的体积为2.24L(标准状况).则( )| A. | 被还原的H2SO4为0.2moL | |
| B. | 反应中共转移电子0.1moL | |
| C. | 反应消耗了金属Cu6.4g | |
| D. | 生成的CuSO4配成500mL溶液,浓度为1mol/L |
分析 铜粉与浓硫酸混合加热,发生反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,加热条件下,浓硫酸和Cu反应生成二氧化硫但稀硫酸和Cu不反应,以此来解答.
解答 解:铜粉与浓硫酸混合加热,发生反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,加热条件下,浓硫酸和Cu反应生成二氧化硫但稀硫酸和Cu不反应,
A.由反应可知,被还原的H2SO4全部转化为SO2,则被还原的H2SO4为0.1moL,故A不选;
B.反应生成二氧化硫为0.1mol,则转移电子为02mol,故B不选;
C.由反应可知,n(Cu)=n(SO2)=0.1mol,则Cu的质量为0.1mol×64g/mol=6.4g,故C选;
D.由反应可知,n(Cu)=n(SO2)=n(CuSO4)=0.1mol,则生成的CuSO4配成500mL溶液,浓度为0.2mol/L,故D不选;
故选C.
点评 本题考查铜和浓硫酸的反应,侧重考查基本计算,明确稀硫酸和铜不反应是解本题关键,根据各个物理量之间的关系式解答即可,题目难度不大.

练习册系列答案
相关题目
6.在硫酸的工业制法中,下列生产操作及主要原因都正确的是( )
| A. | 硫铁矿煅烧前需适当粉碎,目的是增大反应物转化率 | |
| B. | 沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应 | |
| C. | 接触室中使用热交换器,主要目的是提高SO2的转化率 | |
| D. | 吸收塔中用98.3%硫酸吸收SO3,目的是防止形成酸雾,SO3使吸收完全 |
4.将金属钠分别投入下列物质的水溶液中,既有气体又有沉淀生成的是( )
| A. | MgCl2 | B. | K2SO4 | C. | NaCl | D. | HCl |
11.以环戊烷为原料制备环戊二烯的合成路线如图,则( )
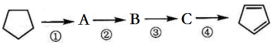
| A. | A的结构简式是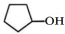 | |
| B. | ①②的反应类型分别是取代、消去 | |
| C. | 反应②③的条件分别是浓硫酸加热、光照 | |
| D. | 酸性KMnO4溶液褪色可证明  已完全转化成 已完全转化成  |
1.在25℃的纯水中,水的离子积(KW)为( )
| A. | KW=1×10-14 | B. | 大于1×10-14 | C. | 小于1×10-14 | D. | 0.01 |
8.将镁、铝各0.3mol分别放入100mL1mol•L-1的盐酸中,同温同压下产生气体的体积比是( )
| A. | 2:3 | B. | 1:1 | C. | 3:2 | D. | 2:1 |
14.下列关于硫及含硫化合物的叙述不正确的是( )
| A. | SO2能使品红溶液褪色 | |
| B. | 硫在空气中燃烧生成大量SO3 | |
| C. | 浓硫酸用作干燥剂 | |
| D. | 常温下铝遇浓硫酸钝化,因此可用铝槽车储运浓硫酸 |
15.下列各种高聚物中,具有热固性的是( )
| A. | 聚乙烯 | B. | 聚氯乙烯 | C. | 聚丙烯 | D. | 酚醛塑料 |