题目内容
8.将镁、铝各0.3mol分别放入100mL1mol•L-1的盐酸中,同温同压下产生气体的体积比是( )| A. | 2:3 | B. | 1:1 | C. | 3:2 | D. | 2:1 |
分析 镁和铝分别与稀盐酸反应方程式为:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余.
解答 解:镁和铝分别与稀盐酸反应方程式为:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,
所以镁和铝都剩余,二者与酸反应生成氢气的量相等,所以同温同压下产生的气体的物质的量之比=0.05mol:0.05mol=1:1,
故选B.
点评 本题考查了根据方程式计算,题目难度不大,明确发生反应的原理为解答关键,注意根据反应物的量正确判断过量情况,为易错题,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | 用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 通过浓硫酸除去HCl中的H2O | |
| D. | 通过灼热的CuO除去H2中的CO |
19.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物一定是酸 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 氯气溶于水后的溶液能导电,故氯气属于电解质 |
16.加热金属Cu与浓硫酸反应,得到SO2的体积为2.24L(标准状况).则( )
| A. | 被还原的H2SO4为0.2moL | |
| B. | 反应中共转移电子0.1moL | |
| C. | 反应消耗了金属Cu6.4g | |
| D. | 生成的CuSO4配成500mL溶液,浓度为1mol/L |
3.实验室常用氯化铵与氢氧化钙的固体混合物加热制取氨气,该反应的化学方程式为:2NH4Cl+Ca(OH)2$\stackrel{△}{→}$CaCl2+2NH3↑+2H2O.下列是实验室提供的有关装置:
(1)请从图中选择实验室制取氨气的气体发生装置b(填序号)、气体收集装置①(填序号).
(2)某学生用100mL注射器收集了50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头.充分振荡后,注射器内无(填“有”或“无”)气体剩余,其中的液体呈红色,请用方程式解释液体颜色变化的原因:NH3+H2O?NH3•H2O?NH4++OH-.
(3)氨具有广泛的用途,它可用于制造化肥/制造硝酸/作冷却剂(举出一种即可).工业上合成氨常常要用铁触媒作催化剂,所加催化剂能否提高N2的转化率不能.理由是催化剂只改变化学反应速率,不影响平衡移动.
(4)工业合成氨的简易流程如下:

通过循环Ⅰ可利用的气态物质是D
A.催化剂 B.只有N2C.只有H2 D.N2和H2.
| 气体发生装置 |  a |  b |  c |
| 气体收集装置 |  ① |  ② |  ③ |
(2)某学生用100mL注射器收集了50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头.充分振荡后,注射器内无(填“有”或“无”)气体剩余,其中的液体呈红色,请用方程式解释液体颜色变化的原因:NH3+H2O?NH3•H2O?NH4++OH-.
(3)氨具有广泛的用途,它可用于制造化肥/制造硝酸/作冷却剂(举出一种即可).工业上合成氨常常要用铁触媒作催化剂,所加催化剂能否提高N2的转化率不能.理由是催化剂只改变化学反应速率,不影响平衡移动.
(4)工业合成氨的简易流程如下:

通过循环Ⅰ可利用的气态物质是D
A.催化剂 B.只有N2C.只有H2 D.N2和H2.
2.氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
(1)BCl3的空间构型为;溴的价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2═CsCl+ICl
B. CsICl2═CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
(4)下列分子既不存在s-pσ键,也不存在p-pπ键的是D.
A. HCl B.HF C.CO2 D. SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3杂化,写出CN-的等电子体的分子式(写出1个)N2或CO.
(6)由H、N、O三种元素组成的常用作化肥,且水溶液显酸性化合物固态时属于离子晶体,假设其晶体的空间结构与氯化钠相似,且晶胞的棱长为acm,则该晶胞的密度为$\frac{320}{{N}_{A}•{a}^{3}}$g/cm3.
(1)BCl3的空间构型为;溴的价电子排布式为4s24p5.
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A. CsICl2═CsCl+ICl
B. CsICl2═CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(KJ/mol) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C.CO2 D. SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3杂化,写出CN-的等电子体的分子式(写出1个)N2或CO.
(6)由H、N、O三种元素组成的常用作化肥,且水溶液显酸性化合物固态时属于离子晶体,假设其晶体的空间结构与氯化钠相似,且晶胞的棱长为acm,则该晶胞的密度为$\frac{320}{{N}_{A}•{a}^{3}}$g/cm3.
6.下列反应中,属于加成反应的是( )
| A. | CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl | |
| B. | CH2=CH2+HOCl$\stackrel{催化剂}{→}$HOCH2-CH2Cl | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. |  +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ -Br+HBr -Br+HBr |
 图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
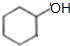 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O反应类型是消去反应.由F生成G的化学方程式
+H2O反应类型是消去反应.由F生成G的化学方程式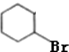 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +2H2O.
+2H2O.