题目内容
5. 某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验:
某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验:(1)定性实验
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝.能否说明样品中含结晶水,试简述理由不能,因为NaHCO3受热分解也能产生水蒸气;
②请设计一个简单方案,确认样品中含有CO32-取少量天然碱样品溶于水,加入足量的氯化钙溶液或氯化钡溶液,过滤并洗涤沉淀,向沉淀中加入稀盐酸,将产生的气体通入澄清石灰水,若出现浑浊现象说明样品中含CO32-;.
(2)定量分析
该同学设计了如图所示装置,测定天然碱的化学组成.
实验步骤:
①组装好实验装置后,首先进行的操作是检查装置的气密性;A处碱石灰的作用是:除去空气中的CO2和H2O(g);E处碱石灰的作用是防止空气中CO2和H2O(g)进入D装置,导致测量不准确.
②称7.3g样品,放入硬质玻璃管中;称量C装置质量为87.6g,D装置为74.7g.
③打开活塞K1、K2,关闭K3,通人空气数分钟.
④关闭活塞Kl、K2,打开K3,点燃酒精灯至不再产生气体为止.
⑤打开活塞Kl,鼓人空气数分钟,然后称得C装置质量为88.5g;D装置质量为75.8g,通入空气的目的是将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收.
⑥该天然碱的化学式为Na2CO3•2NaHCO3•H2O.
分析 (1)①碳酸氢钠分解会生成水,所以取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝,不能说明样品中含有结晶水;
②依据样品中碳酸根离子会结合钙离子或钡离子生成白色沉淀,碳酸氢根离子不与氯化钙或氯化钡溶液反应,据此设计实验检验;
(2)①装载气密性会影响测定结果,所以实验前必须检查装置的气密性,没有装置E,空气中的二氧化碳和水会进入装置D,影响测定结果;
⑤缓缓鼓入空气的目的是将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收;
⑥根据碱石灰的质量变化计算出二氧化碳的质量,从而计算出碳酸氢钠的物质的量及碳酸氢钠分解生成的水的物质的量,再根据浓硫酸的质量变化及碳酸氢钠分解生成水的质量计算出结晶水质量,最后计算出样品中碳酸钠的质量,从而得出该样品的化学式;
解答 解:(1)①由于反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O中有水生成,所以不能说明样品中含结晶水,
故答案为:不能,因为NaHCO3受热分解也能产生水蒸气;
②样品中碳酸根离子会结合钙离子或钡离子生成白色沉淀,碳酸氢根离子不与氯化钙或氯化钡溶液反应,取少量天然碱样品溶于水,加入足量的氯化钙溶液或氯化钡溶液,过滤并洗涤沉淀,向沉淀中加入稀盐酸,将产生的气体通入澄清石灰水,若出现浑浊现象说明样品中含CO32-,
故答案为:取少量天然碱样品溶于水,加入足量的氯化钙溶液或氯化钡溶液,过滤并洗涤沉淀,向沉淀中加入稀盐酸,将产生的气体通入澄清石灰水,若出现浑浊现象说明样品中含CO32-;
(2)①该实验中使用了多个实验装置,在实验前必须检查装置的气密性,避免影响测定结果;装置A中的碱石灰作用是除去空气中的CO2和H2O(g),本实验是通过测定生成二氧化碳和水的物质的量计算出样品的组成,如果没有装置E,空气的中CO2和H2O(g)进入D装置,导致测量结果不准确装置E是防止空气中CO2和H2O(g)进入D装置,导致测量不准确,
故答案为:检查装置的气密性;除去空气中的CO2和H2O(g);防止空气中CO2和H2O(g)进入D装置,导致测量不准确;
⑤该步骤中缓缓鼓入空气的目的是将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收,减小测定误差,
故答案为:将装置中生成的CO2和H2O(g)全部排入C、D装置中吸收;
⑥由题意可知:装碱石灰的U形管D的增重的物质是CO2,二氧化碳的质量为:75.8 g-74.7=1.1 g,n(CO2)=$\frac{1.1g}{44g/mol}$=0.025 mol,
则2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O
2 1 1 1
0.05mol 0.025mol 0.025mol 0.025mol
m(NaHCO3)=0.05 mol×84 g•mol-1=4.2 g
浓硫酸吸收的水为碳酸氢钠分解生成的和样品中的结晶水,水的质量之和为:88.5g-87.6g=0.9g,
所以晶体中含有的结晶水的物质的量为:n(H2O)=$\frac{0.9g}{18g/mol}$-0.025mol=0.025mol,
样品中含有的结晶水的质量为:m(H2O)=0.025 mol×18 g•mol-1=0.45g,
样品中含有的水的质量为:m(Na2CO3)=7.3g-4.2g-0.45g=2.65g,n(Na2CO3)=$\frac{2.65g}{106g/mol}$=0.025mol,
故晶体中n(Na2CO3):n(NaHCO3):n(H2O)=0.025 mol:0.05 mol:0.025 mol=1:2:1,
所以晶体化学式为:Na2CO3•2NaHCO3•H2O,
故答案为:Na2CO3•2NaHCO3•H2O;
点评 本题考查Na2CO3和NaHCO3有关性质、化学计算等知识,试题综合性较强,题目难度较大,注意掌握碳酸钠、碳酸氢钠的性质,明确化学计算的方法与技巧,试题培养了学生的分析、理解能力.

| A. | 混合气体密度恒定不变 | B. | 消耗n mol H2同时生成2n mol HI | ||
| C. | H2、I2、HI的浓度相等 | D. | 混合气体的颜色不再改变 |
| A. | c(OH-)=2.0×10-7mol•L-1 | B. | Kw=1×10-14 | ||
| C. | c(OH-)=1.0×10-14/2.0×10-7mol•L-1 | D. | 温度为25℃ |
| A. | SO32-、NO3-、Na+、K+ | B. | Na+、SO42-、Cl-、K+ | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、K+、AlO2-、SO42- |
| A. | 40℃时,0.005mol/LH2SO4溶液的pH为2 | |
| B. | 往氯化铁溶液中滴加氨水来制备氢氧化铁胶体 | |
| C. | 镀锌铁制品镀层受损后,铁制品易生锈 | |
| D. | 已知NaOH溶液和CH3COONH4溶液均显示中性,则两溶液中水的电离程度相同 |
(1)C的生成速率与C的分解速率相等;
(2)单位时间内amol A生成,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A、B、C的分子数目比为1:3:2.
| A. | (2)(4)(5) | B. | (2)(7) | C. | (1)(3)(4) | D. | (5)(6)(7) |
| A. | 用托盘天平称取21.82g食盐 | |
| B. | 用酸式滴定管量取15.30mL 0.10mol/L H2SO4溶液 | |
| C. | 用量筒量取13.56mL盐酸 | |
| D. | 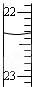 滴定达终点时,右图滴定管的正确读数为23.65mL |