题目内容
14.化学学习活动小组学习了铁铜化合物知识后,查阅资料,积极思考,提出了一系列问题,请予以解答:(1)氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3═2CuCl↓+3Na2SO4+CO2↑
查阅资料可得,CuCl可以溶解在FeCl3溶液中,请写出该反应的离子方程式是CuCl+Fe3+=Cu2++Fe2++Cl-;
(2)已知:Cu2O在酸溶液中发生歧化反应:Cu2O+2H+═Cu2++Cu+H2O
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体),此时溶液中一定含有的阳离子H+、Fe2+(用离子符号表示);继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化Fe3+、Cu2+、Fe2+、Cl-(用离子符号表示);不通入气体,改往W中加入过量铁粉,过滤,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是2Fe2++3H2O2+4I-=2Fe(OH)3+2I2.
分析 (1)CuCl可以溶解在FeCl3溶液中,发生氧化还原反应生成Cu2+和Fe2+;
(2)Fe2O3、Cu2O、CuCl、Fe溶解于过量稀盐酸中,发生CuCl+Fe3+=Cu2++Fe2++Cl-、Cu2O+2H+═Cu2++Cu+H2O、2Fe3++Cu=2Fe2++Cu2+、2Fe3++Fe=3Fe2+,如有固体剩余,只能是还原性最弱的Cu,反应后溶液中存在H+、Fe2+等离子,通入氯气,Fe2+被氧化,以此解答.
解答 解:(1)CuCl可以溶解在FeCl3溶液中,发生氧化还原反应生成Cu2+和Fe2+,反应的离子方程式为CuCl+Fe3+=Cu2++Fe2++Cl-,
故答案为:CuCl+Fe3+=Cu2++Fe2++Cl-;
(2)Fe2O3、Cu2O、CuCl、Fe溶解于过量稀盐酸中,发生CuCl+Fe3+=Cu2++Fe2++Cl-、Cu2O+2H+═Cu2++Cu+H2O、2Fe3++Cu=2Fe2++Cu2+、2Fe3++Fe=3Fe2+,如有固体剩余,只能是还原性最弱的Cu,反应后溶液中存在H+、Fe2+等离子,通入氯气,Fe2+被氧化,发生2Fe2++Cl2=2Fe3++2Cl-、2Fe3++Cu=2Fe2++Cu2+,溶液中,Fe3+、Cu2+、Fe2+、Cl-发生变化,不通入气体,改往W中加入过量铁粉,过滤,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2mol I-时,共转移3mol电子,通式亚铁离子被氧化,该反应的离子方程式是2Fe2++3H2O2+4I-=2Fe(OH)3+2I2,
故答案为:H+、Fe2+;Fe3+、Cu2+、Fe2+、Cl-;2Fe2++3H2O2+4I-=2Fe(OH)3+2I2.
点评 本题考查氧化还原反应的计算,题目难度中等,判断氧化物中氧原子的物质的量是解题的关键,注意掌握守恒思想在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.

| A. | 氢氧化铜与硫酸反应:Cu(OH)2+2H+=Cu2++2H2O | |
| B. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氧化铜与硫酸反应:CuO+2H+=Cu2++H2O |
| A. | O2和O3 | B. | ${\;}_{1}^{2}$H和${\;}_{1}^{2}$H | ||
| C. | 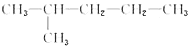 和CH3-CH2-CH2-CH2-CH2-CH3 和CH3-CH2-CH2-CH2-CH2-CH3 | D. | CH3-CH2-CH3和CH3-CH2-CH2-CH3 |
| A. | 纯水 | B. | 碳酸钠溶液 | C. | 氯化钙溶液 | D. | 盐酸 |
| A. | Ba(OH)2.8H2O与NH4Cl反应 | B. | 钠与冷水的反应 | ||
| C. | 灼热的炭与CO2反应 | D. | 甲烷与O2的燃烧反应 |

 某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验:
某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验: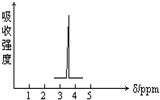 化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:BrCH2CH2Br,请预测B的核磁共振氢谱上有2个峰(信号),强度之比为3:1.
化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:BrCH2CH2Br,请预测B的核磁共振氢谱上有2个峰(信号),强度之比为3:1.