题目内容
10.已知某溶液中加入铝粉产生氢气,在此溶液中肯定能够大量共存的离子组是( )| A. | SO32-、NO3-、Na+、K+ | B. | Na+、SO42-、Cl-、K+ | ||
| C. | NH4+、K+、SO42-、Cl- | D. | Na+、K+、AlO2-、SO42- |
分析 加入铝粉产生氢气,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:加入铝粉产生氢气,为非氧化性酸或强碱溶液,
A.酸溶液中SO32-、NO3-发生氧化还原反应不能共存,故A不选;
B.酸、碱溶液中该组离子之间均不反应,一定大量共存,故B选;
C.碱溶液中不能大量存在NH4+,故C不选;
D.酸溶液中不能大量存在AlO2-,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 实验室制取乙烯时浓硫酸是催化剂和吸水剂 | |
| B. | 硝基苯制备时浓硫酸作催化剂和脱水剂 | |
| C. | 实验室制备乙烯、硝基苯、苯磺酸时均使用到温度计,且水银球在反应混合物液面以下 | |
| D. | 水浴加热的优点是可以受热均匀且便于控制温度 |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 17gNH3中含有的质子数为10NA | |
| B. | 标准状况下,22.4LCl2与56gFe反应生成FeCl2分子的数目为NA | |
| C. | 7.0g丁烯含有C-H键的数目为NA | |
| D. | 常温下,1.0LpH=1的H2SO4溶液中,由水电离出的0H-的数目为0.1NA |
2.下列离子方程式中,不正确的是( )
| A. | 氢氧化铜与硫酸反应:Cu(OH)2+2H+=Cu2++2H2O | |
| B. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氧化铜与硫酸反应:CuO+2H+=Cu2++H2O |

 向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.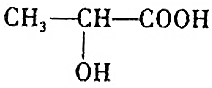 的反应(官能团羟基、羧基,具有醇和酸的性质)
的反应(官能团羟基、羧基,具有醇和酸的性质) 某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验:
某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验: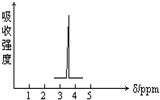 化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:BrCH2CH2Br,请预测B的核磁共振氢谱上有2个峰(信号),强度之比为3:1.
化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:BrCH2CH2Br,请预测B的核磁共振氢谱上有2个峰(信号),强度之比为3:1.