题目内容
10.已知:CH3OCH3(g)+H2O(g)=2CH3OH(g)△H=+23.9KJ/mol
CH3OCH3(g)=CH3CH2OH(g)△H=-50.7KJ/mol
C2H4(g)+2H2O(g)=2CH3OH(g)△H=+29.1KJ/mol
写出乙醇脱水生成乙烯气体的热化学方程式:CH3CH2OH(g)=C2H4(g)+H2O(g)△H=+45.5KJ/mol.
分析 已知:①CH3OCH3(g)+H2O(g)=2CH3OH(g)△H=+23.9KJ/mol
②CH3OCH3(g)=CH3CH2OH(g)△H=-50.7KJ/mol
③C2H4(g)+2H2O(g)=2CH3OH(g)△H=+29.1KJ/mol
根据盖斯定律,①-②-③可得CH3CH2OH(g)=C2H4(g)+H2O(g),据此计算出其焓变,从而可得乙醇脱水生成乙烯气体的热化学方程式.
解答 解:已知:①CH3OCH3(g)+H2O(g)=2CH3OH(g)△H=+23.9KJ/mol
②CH3OCH3(g)=CH3CH2OH(g)△H=-50.7KJ/mol
③C2H4(g)+2H2O(g)=2CH3OH(g)△H=+29.1KJ/mol
根据盖斯定律,①-②-③可得:CH3CH2OH(g)=C2H4(g)+H2O(g)△H=(+23.9KJ/mol)-(-50.7KJ/mol)-(+29.1KJ/mol)=+45.5KJ/mol,
故答案为:CH3CH2OH(g)=C2H4(g)+H2O(g)△H=+45.5KJ/mol.
点评 本题考查了盖斯定律的应用、热化学方程式的书写,题目难度中等,明确盖斯定律的含义为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 17gNH3中含有的质子数为10NA | |
| B. | 标准状况下,22.4LCl2与56gFe反应生成FeCl2分子的数目为NA | |
| C. | 7.0g丁烯含有C-H键的数目为NA | |
| D. | 常温下,1.0LpH=1的H2SO4溶液中,由水电离出的0H-的数目为0.1NA |
2.下列离子方程式中,不正确的是( )
| A. | 氢氧化铜与硫酸反应:Cu(OH)2+2H+=Cu2++2H2O | |
| B. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氧化铜与硫酸反应:CuO+2H+=Cu2++H2O |
19.现有二氧化硅、石灰石、硅酸钠三种白色粉末,只用一种试剂就可以将它们鉴别开,该试剂是( )
| A. | 纯水 | B. | 碳酸钠溶液 | C. | 氯化钙溶液 | D. | 盐酸 |
 向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7. 某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验:
某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验: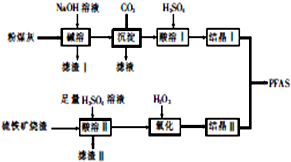 聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下: