题目内容
13.在某温度时,测得纯水中的c(H+)=2.0×10-7mol•L-1,下列说法正确的是( )| A. | c(OH-)=2.0×10-7mol•L-1 | B. | Kw=1×10-14 | ||
| C. | c(OH-)=1.0×10-14/2.0×10-7mol•L-1 | D. | 温度为25℃ |
分析 常温下纯水中的c(H+)=1.0×10-7mol•L-1,某温度时,测得纯水中的c(H+)=2.0×10-7mol•L-1>1.0×10-7mol•L-1,则促进水的电离,温度大于25℃,以此来解答.
解答 解:A.纯水中的c(H+)=2.0×10-7mol•L-1=c(OH-),故A正确;
B.Kw=2.0×10-7mol•L-1×2.0×10-7mol•L-1=4.0×10-14(mol•L-1)2,故B错误;
C.纯水中的c(H+)=2.0×10-7mol•L-1=c(OH-),故C错误;
D.c(H+)=2.0×10-7mol•L-1>1.0×10-7mol•L-1,则促进水的电离,温度大于25℃,故D错误;
故选A.
点评 本题考查弱电解质的电离,为高频考点,把握水电离的氢离子与氢氧根离子浓度相等为解答的关键,侧重分析与应用能力的考查,注意水的电离吸热,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.下列结构简式代表了几种不同的烷烃( )
①
②
③
④
⑤
①

②

③

④

⑤

| A. | 1种 | B. | 2种 | C. | 3种 | D. | 5种 |
8.下列说法正确的是( )
| A. | 0.1mol•L-1某一元弱酸(HA)溶液中:c2(H+)=c(H+)•c(A-)+Kw | |
| B. | 已知Ka(HNO2)=4.6×10-4,Kb(NH3•H2O)=1.8×10-5,可推断NH4NO3溶液呈碱性 | |
| C. | 25℃时,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$先增大后减小 | |
| D. | NH4Cl溶液中滴加NaOH溶液至溶液呈中性时,则有c(Na+)>c(NH3•H2O) |
6.下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
| A. | Ba(OH)2.8H2O与NH4Cl反应 | B. | 钠与冷水的反应 | ||
| C. | 灼热的炭与CO2反应 | D. | 甲烷与O2的燃烧反应 |

 向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.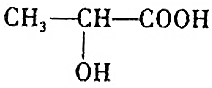 的反应(官能团羟基、羧基,具有醇和酸的性质)
的反应(官能团羟基、羧基,具有醇和酸的性质) 某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验:
某天然碱样品的组成可能为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数).为确定其组成,某小组进行如下实验: