题目内容
16.铬铁矿的主要成分为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备(K2Cr2O7)的工艺如下(部分操作和条件略).
已知:①NaFeO2遇水强烈水解 ②Cr2O72-+H2O?2CrO42-+2H+
请根据题意回答下列问题:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是4FeO•Cr2O3+20NaOH+7O2$\frac{\underline{\;\;△\;\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O;
(2)滤液1的溶质除Na2CrO4外,还含有NaAlO2、NaOH(填化学式,下同),滤渣1的成分是MgO、Fe(OH)3.
(3)向滤液2中继续加入醋酸调pH<5,其目的是加入酸,c(H+)增大,Cr2O72-+H2O?2CrO42-+2H+平衡左移,使CrO42-转化为Cr2O72-.
(4)酸性溶液中过氧化氢能使Cr2O72-变成蓝色的CrO5,其分子结构为
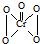 ,该反应
,该反应可用来检验Cr2O72-的存在.写出反应的离子方程式Cr2O72-+4H2O2+2H+=2CrO5+5H2O,该反应不属于(填“属于”或“不属于”)氧化还原反应.
(5)称取重铬酸钾试样5.00g配成250mL溶液,取出25mL,加入10mL 2mol•L-1 H2SO4和足量碘化钾(铬的还原产物为Cr3+),加入几滴淀粉溶液做指示剂,用0.30mol•L-1 Na2S2O3标准溶液滴定(I2+2S2O32-═2I-+S4O62-).若实验中共用去Na2S2O3标准溶液30.00mL,则所得产品中重铬酸钾的纯度为88.2%.(保留3位有效数字,K2Cr2O7的摩尔质量为294g/mol)
分析 铬铁矿中主要有FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氢氧化钠固体和氧气通过焙烧,生成Na2CrO4、NaFeO2、MgO、NaOH和NaAlO2的混合体系,因为NaFeO2遇水强烈水解,加水溶解得固体MgO、Fe(OH)3,溶液Na2CrO4、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全沉淀,继续调节溶液的pH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)根据Na2CrO4和NaFeO2的性质,铬元素由+3价升到+6价,铁元素由+2价升高到+3价,氧元素化合价降低,根据氧化还原反应化合价升降守恒配平;
(2)加入氢氧化钠固体和氧气通过焙烧,生成Na2CrO4、NaFeO2、MgO、NaOH和NaAlO2的混合体系,因为NaFeO2遇水强烈水解,加水溶解得固体MgO、Fe(OH)3,溶液Na2CrO4、NaOH、NaAlO2;
(3)Cr2O72-+H2O?2CrO42-+2H+,加大氢离子浓度使反应平衡逆向移动,将CrO42-转化为Cr2O72-;
(4)过氧化氢能使Cr2O72-变成蓝色的CrO5,根据电荷守恒和原子守恒配平,根据结构可知,元素化合价没有变化;
(5)根据反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 中碘单质的性质选择指示剂,利用关系式Cr2O72-~6S2O32-进行计算.
解答 解:铬铁矿中主要有FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,加入氢氧化钠固体和氧气通过焙烧,生成Na2CrO4、NaFeO2、MgO、NaOH和NaAlO2的混合体系,因为NaFeO2遇水强烈水解,加水溶解得固体MgO、Fe(OH)3,溶液Na2CrO4、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全沉淀,继续调节溶液的pH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)根据Na2CrO4和NaFeO2的性质,铬元素由+3价升到+6价,铁元素由+2价升高到+3价,氧元素化合价降低,反应的方程式为4FeO•Cr2O3+20NaOH+7O2$\frac{\underline{\;\;△\;\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O,
故答案为:4FeO•Cr2O3+20NaOH+7O2$\frac{\underline{\;\;△\;\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O;
(2)加入氢氧化钠固体和氧气通过焙烧,生成Na2CrO4、NaFeO2、MgO、NaOH和NaAlO2的混合体系,因为NaFeO2遇水强烈水解,加水溶解得固体MgO、Fe(OH)3,溶液Na2CrO4、NaOH、NaAlO2;滤液1的成分除Na2CrO4外,还含有NaOH、NaAlO2,滤渣1为MgO、Fe(OH)3,
故答案为:NaAlO2、NaOH;MgO、Fe(OH)3;
(3)Cr2O72-+H2O?2CrO42-+2H+,向滤液2中继续加入醋酸调pH<5,加大氢离子浓度使反应平衡逆向移动,将CrO42-转化为Cr2O72-,
故答案为:加入酸,c(H+)增大,Cr2O72-+H2O?2CrO42-+2H+平衡左移,使CrO42-转化为Cr2O72-;
(4)过氧化氢能使Cr2O72-变成蓝色的CrO5,根据电荷守恒和原子守恒知方程式为Cr2O72-+4H2O2+2H+=2CrO5+5H2O,因为CrO5的分子结构为 ,总共形成了6个键,说明Cr元素的化合物价没有发生改变,过氧化氢的化合价也没改变,故不属于氧化还原反应,
,总共形成了6个键,说明Cr元素的化合物价没有发生改变,过氧化氢的化合价也没改变,故不属于氧化还原反应,
故答案为:Cr2O72-+4H2O2+2H+=2CrO5+5H2O;不属于;
(5)根据反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 中碘单质的产生于消耗情况选择淀粉作为指示剂,当溶液由蓝色恰好变为无色且半分钟不回复原来的颜色,说明达到了滴定终点,由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,存在
Cr2O72-~6S2O32-,
1 6
n 0.30×0.030mol
则250ml含重铬酸钾的物质的量为n=$\frac{0.30×0.030mol}{6}$×10,则所得产品中重铬酸钾纯度为$\frac{0.30×0.030mol×10×294}{6×5.00}$×100%=88.2%,
故答案为:淀粉;88.2%.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,注意利用关系式进行计算,题目难度较大.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 若(a+b)<(c+d),则反应一定能自发向右进行 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比也为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量大于(m+n)mol | |
| D. | 若a+b=c,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大 |
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50-60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O
+H2O 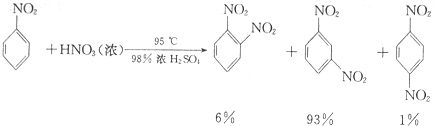
(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
(1)配置混酸应先在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为70%(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是停止加热,待冷却后加入.
| A. |  用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. |  图装置可用于收集H2、NH3、NO等气体 | |
| C. |  图装置能较长时间观察到Fe(OH)2白色沉淀 | |
| D. |  图能比较MnO2、Cl2、I2的氧化性 |
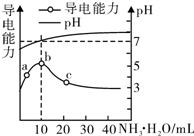
| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c点溶液存在c( NH4+)>c( R-)、c(OH-)>c(H+) | |
| D. | b~e任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
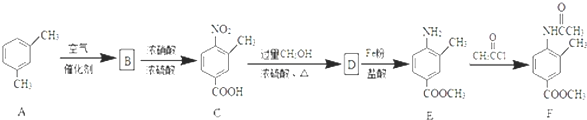
 ;由D→E的反应类型是还原反应.
;由D→E的反应类型是还原反应. .
. .
.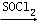 RCOCl.请写出以CH3CH2OH、
RCOCl.请写出以CH3CH2OH、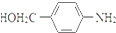 为原料,制备化合物
为原料,制备化合物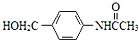 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2 CH3CH2Br
CH3CH2Br CH3CH2OH.
CH3CH2OH.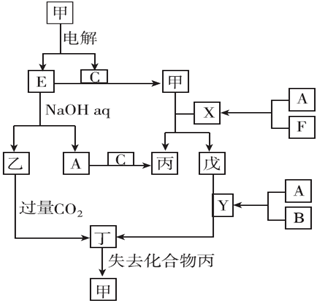
 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子. ,写出该反应的化学方程式IBr+H2O=HBr+HIO.
,写出该反应的化学方程式IBr+H2O=HBr+HIO.