题目内容
8. 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50-60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O
+H2O 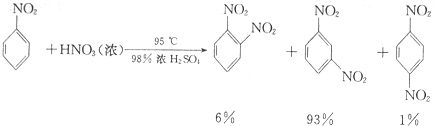
(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
(1)配置混酸应先在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为70%(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是停止加热,待冷却后加入.
分析 (1)将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌,如果将浓硝酸加到浓硫酸中可能发生液体飞溅的情况;
(2)恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下;
(3)苯、浓硝酸沸点低,易挥发,长玻璃管能冷凝回流挥发的苯、浓硝酸,据此选择替代仪器;
(4)具有苦杏仁味的硝基苯的密度比水大,分离互不相溶的液态,采取分液操作;
(5)反应得到粗产品中有残留的硝酸及硫酸,需要除去,用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤,未洗净晶体表面含有碳酸根离子,检验最后一次洗涤液即可;
(6)要得到纯净的硝基苯,粗产品依次用蒸馏水、10%Na2CO3溶液洗涤,再用蒸馏水洗涤,最后用无水CaCl2干燥、蒸馏,从而得到纯硝基苯;由于18 mL苯的密度为0.88g•cm-3,故其质量为18×0.88=15.84g,根据反应 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O进行计算硝基苯的质量,再计算产率;给液体加热加入沸石可以防止瀑沸,若加热后发现未加沸石,应冷却后补加.
+H2O进行计算硝基苯的质量,再计算产率;给液体加热加入沸石可以防止瀑沸,若加热后发现未加沸石,应冷却后补加.
解答 解:(1)浓硫酸密度大于浓硝酸,应将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌,如果将浓硝酸加到浓硫酸中可能发生液体飞溅,
故答案为:浓硝酸;
(2)和普通分液漏斗相比,恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,
故答案为:可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下;
(3)长玻璃管作用是导气、冷凝回流,该实验中可以冷凝回流挥发的浓硝酸以及苯使之充分反应,减少反应物的损失,提高转化率,可用冷凝管或球形冷凝管或直行冷凝管替代,
故答案为:冷凝管(球形冷凝管或直行冷凝管均可);
(4)硝基苯是油状液体,与水不互溶,密度比水大,在下层,分离互不相溶的液态,采取分液操作,
故答案为:下;分液;
(5)反应得到粗产品中有残留的硝酸及硫酸,用10%Na2CO3溶液洗涤除去粗产品中残留的酸,之后再用蒸馏水洗涤,如果晶体未洗净含有碳酸根离子,取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净,
故答案为:取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净;
(6)用蒸馏水洗涤,硝基苯中含有水,用无水CaCl2干燥,然后将较纯的硝基苯进行蒸馏,得到纯硝基苯;由于18 mL苯的密度为0.88g•cm-3,故其质量为18×0.88=15.84g,根据反应 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O,可知硝基苯的质量=$\frac{123×15.84}{78}$≈25g,故硝基苯的产率为$\frac{17.5}{25}×100%$=70%;给液体加热加入沸石可以防止瀑沸,若加热后发现未加沸石,应冷却后补加,
+H2O,可知硝基苯的质量=$\frac{123×15.84}{78}$≈25g,故硝基苯的产率为$\frac{17.5}{25}×100%$=70%;给液体加热加入沸石可以防止瀑沸,若加热后发现未加沸石,应冷却后补加,
故答案为:氯化钙;70%;停止加热,待冷却后加入.
点评 本题主要考查硝基苯的制取、物质的分离方法及产率的计算等知识点,题目难度中等,为高考的高频题,试题综合性较强,知识点较全面,正确理解制备原理为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案| A. | Na+、Al3+、Cl-、OH-(5:2:4:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | D. | K+、H+、I-、NO3-(1:1:1:1) |
| A. | R的单质在通常情况下呈气态 | B. | R的单质可能是一种无色的固体 | ||
| C. | R的氢化物稳定 | D. | 单质R与H2的化合反应非常困难 |
| A. | 1 mol | B. | 5 mol | C. | 6 mol | D. | 2 mol |
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- | |
| C. | 该消毒液与洁厕灵(成分为HCl)混用,产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O | |
| D. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- |
| A. | 农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 | |
| B. | 用于新版人民币票面图案等处的油墨中所含的Fe3O4是一种磁性物质 | |
| C. | 双氧水、高锰酸钾溶液可以杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理不相同 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
 N2H4(肼)可作用制药的原料,也可作火箭的燃料.(1)肼能与酸反应.N2H6Cl2溶液呈弱酸性,在水中存在如下反应:
N2H4(肼)可作用制药的原料,也可作火箭的燃料.(1)肼能与酸反应.N2H6Cl2溶液呈弱酸性,在水中存在如下反应:
 ,该反应
,该反应
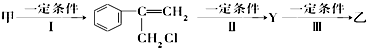
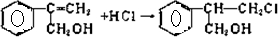 (不需注明反应条件).
(不需注明反应条件).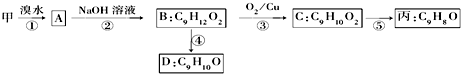
 .
. 、
、 、
、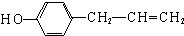 (任写一种).
(任写一种).