题目内容
5.下列关于有机物的叙述正确的是( )| A. | 1,2-二氯乙烷在NaOH水溶液中加热发生消去反应得到乙炔 | |
| B. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| C. | 除去电石和水反应产生的乙炔中杂质气体,可用稀硫酸洗气 | |
| D. | 由丙烯酸甲酯CH2=CHCOOCH3合成的聚合物为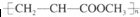 |
分析 A.1,2-二氯乙烷在NaOH水溶液中发生水解反应;
B.石油液化气、汽油和石蜡主要成分都是烃类;
C.杂质主要为硫化氢,与稀硫酸不反应;
D.高分子链节中含2个C.
解答 解:A.1,2-二氯乙烷在NaOH水溶液中发生水解反应,生成乙二醇,在NaOH醇溶液中发生消去反应,故A错误;
B.石油液化气(主要为丙烷和丁烷)、汽油(主要为烷烃)和石蜡(主要为烷烃)主要成分都是烃类,即碳氢化合物,故B正确;
C.杂质主要为硫化氢,与稀硫酸不反应,应利用硫酸铜溶液除去,故C错误;
D.高分子链节中含2个C,则聚合物为的结构简式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
相关题目
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L D2中所含中子数为2NA | |
| B. | 1 molCO2与1L 2mol/L的NaOH溶液反应后,溶液中的CO32-数为0.5 NA | |
| C. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| D. | 3.36L氯气与2.7g铝充分反应,转移电子数一定为0.3NA |
16.已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O?H++Cl-+HClO、HClO?H++ClO-,达到平衡后,要使HClO的浓度增大,可加入足量的下列哪种物质( )
| A. | SO2 | B. | NaHCO3 | C. | HCl | D. | NaOH |
13.下列说法一定正确的是( )
| A. | 反应A(s)?2B(g)+C(g),当C的体积分数不变时,反应达到平衡状态 | |
| B. | 将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq) | |
| D. | 增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
20.下列说法中错误的是( )
| A. | 淀粉、纤维素和蛋白质均属于高分子化合物 | |
| B. | 用漂白粉漂白时,向水溶液中加几滴白醋,会增强漂白效果 | |
| C. | 利用乙醇的还原性以及Cr3+、Cr2O7-的颜色差异来检验酒后驾车 | |
| D. | 合成纤维和光导纤维都是新型无机非金属材料 |
10.一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)?2SCl2(鲜红色液体)△H=-61.16kJ•mol-1.下列说法正确的是( )
| A. | 增大压强,平衡常数将增大 | |
| B. | 达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2 | |
| C. | 达到平衡时,若升高温度,氯气的百分含量减小 | |
| D. | 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高 |
17.室温下,在一个无色透明恒容的密闭容器中存在如下平衡体系:2NO2 (红棕色,g)?N2O4 (无色,g)△H<0.现将该容器浸入冰水中,则正确现象是( )
| A. | 气体颜色变深 | B. | 气体颜色不变 | C. | 气体颜色变浅 | D. | 先变深后变浅 |
14.下列装置工作时,将化学能转化为电能的是( )
| A. |  燃气灶 | B. |  硅太阳能电池 | C. |  铅蓄电池 | D. |  风力发电机 |
15.标准状况下,将15.68LCO2与500mL2mol/L的NaOH溶液充分反应,生成了Na2CO3和NaHCO3,再将溶液蒸干充分灼烧,得到的固体物质质量为( )
| A. | 84g | B. | 65.4g | C. | 67.6g | D. | 53g |