题目内容
15.标准状况下,将15.68LCO2与500mL2mol/L的NaOH溶液充分反应,生成了Na2CO3和NaHCO3,再将溶液蒸干充分灼烧,得到的固体物质质量为( )| A. | 84g | B. | 65.4g | C. | 67.6g | D. | 53g |
分析 生成了Na2CO3和NaHCO3,再将溶液蒸干充分灼烧,碳酸氢钠分解,最终固体为碳酸钠,结合钠原子守恒计算.
解答 解:生成了Na2CO3和NaHCO3,再将溶液蒸干充分灼烧,碳酸氢钠分解,最终固体为碳酸钠,
由钠原子守恒可知,m(Na2CO3)=$\frac{0.5L×2mol/L}{2}$×106g/mol=53g,
故选D.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及原子守恒法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
5.下列关于有机物的叙述正确的是( )
| A. | 1,2-二氯乙烷在NaOH水溶液中加热发生消去反应得到乙炔 | |
| B. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| C. | 除去电石和水反应产生的乙炔中杂质气体,可用稀硫酸洗气 | |
| D. | 由丙烯酸甲酯CH2=CHCOOCH3合成的聚合物为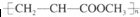 |
6.下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值增大 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)>c(HCO3-),且2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | 常温下0.4 mol•L-1 HB溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| D. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O═Na2CO3+2HClO |
3.下列有关离子检验的操作和实验结论正确的是( )
| A. | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液中一定含有NH4+ | |
| B. | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| C. | 向某溶液中加入氨水,产生白色沉淀,则该溶液中一定含有Mg2+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧,若火焰呈黄色,则证明该溶液中无K+离子 |
10.实验是研究化学的基础,下列有关实验的方法、装置或操作都正确的是( )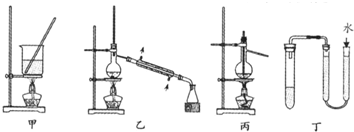

| A. | 用甲装置将海带灼烧成灰 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 利用丙装置进行石油分馏 | |
| D. | 利用丁装置检验装置的气密性 |
20.下列反应中,SO2表现氧化性的是( )
| A. | SO2与水反应 | B. | SO2与H2S溶液反应 | ||
| C. | SO2与NaOH溶液反应 | D. | SO2与酸性高锰酸钾溶液反应 |
7.常温下,一定浓度的某溶液,由水电离出的 c(OH-)=10-4mol•L-1,则该溶液中的溶质可能是( )
| A. | NaOH | B. | H2SO4 | C. | CH3COONa | D. | KCl |



 .
. .
. 有多种同分异构体,其中含有1个醛基和2个羟基,且核磁共振氢谱显示为6组峰的芳香族化合物共有4种.
有多种同分异构体,其中含有1个醛基和2个羟基,且核磁共振氢谱显示为6组峰的芳香族化合物共有4种. 最合理的方案.
最合理的方案.