题目内容
14.下列装置工作时,将化学能转化为电能的是( )| A. |  燃气灶 | B. |  硅太阳能电池 | C. |  铅蓄电池 | D. |  风力发电机 |
分析 将化学能转化为电能,应为原电池装置,结合能量的转化特点判断.
解答 解:A.燃气灶为化学能转化为热能的装置,故A正确;
B.硅太阳能电池为太阳能转化为电能的装置,故B错误;
C.铅蓄电池在放电时属于原电池,是化学能转化为电能的装置,故C正确;
D.风力发电机是把机械能转化为电能,故D错误.
故选C.
点评 本题考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合考查,注意把握常见能量的转化形成,难度不大.

练习册系列答案
相关题目
4.利用碳酸钠晶体(Na2CO3•10H2O)来配制1.0mol•L-1 Na2CO3溶液500mL,假如其他操作均准确无误,下列情况会引起所配溶液浓度偏高的是( )
| A. | 称取碳酸钠晶体53.0g | |
| B. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 | |
| C. | 定容时,俯视观察刻度线 | |
| D. | 定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线 |
5.下列关于有机物的叙述正确的是( )
| A. | 1,2-二氯乙烷在NaOH水溶液中加热发生消去反应得到乙炔 | |
| B. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| C. | 除去电石和水反应产生的乙炔中杂质气体,可用稀硫酸洗气 | |
| D. | 由丙烯酸甲酯CH2=CHCOOCH3合成的聚合物为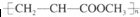 |
2. “C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
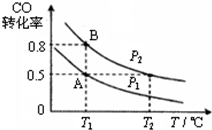
(1)向体积为 2L的密闭容器中充入1mol CO和2mol H2,在一定条件下发生如下反应:CO(g)+2H2(g)?CH3OH(g).经过t秒达到平衡,平衡时CO的转化率与温度、压强的关系如图所示.请回答:
①p1、T1℃时,从开始到平衡的过程中,用H2表示的平均反应速率为$\frac{0.5}{t}$mol•L-1•s-1
②图中压强p1< 压强p2.(填“>”、“<”或“=”)
(2)一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
①容器I中反应达到平衡所需时间比容器Ⅲ中的短(填“长”、“短”或“相等”)
②达到平衡时,容器I中的CH3OH的体积分数相等(填“大于”、“小于”或“相等”)容器Ⅱ中的CH3OH的体积分数.
③若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行(填“正反应”、“逆反应”或“不移动”).
(3)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).若反应在恒容绝热(不
与外界交换能量)条件下进行,按下表数据投料,反应达到平衡状态,测得体系压强升高.
则升高温度,该反应的平衡常数将减小(填“增大”“减小”或“不变”).
 “C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.(1)向体积为 2L的密闭容器中充入1mol CO和2mol H2,在一定条件下发生如下反应:CO(g)+2H2(g)?CH3OH(g).经过t秒达到平衡,平衡时CO的转化率与温度、压强的关系如图所示.请回答:
①p1、T1℃时,从开始到平衡的过程中,用H2表示的平均反应速率为$\frac{0.5}{t}$mol•L-1•s-1
②图中压强p1< 压强p2.(填“>”、“<”或“=”)
(2)一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
| 容器 编号 | 温度(℃) | 起始的物质的量(mol) | 平衡的物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②达到平衡时,容器I中的CH3OH的体积分数相等(填“大于”、“小于”或“相等”)容器Ⅱ中的CH3OH的体积分数.
③若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行(填“正反应”、“逆反应”或“不移动”).
(3)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).若反应在恒容绝热(不
与外界交换能量)条件下进行,按下表数据投料,反应达到平衡状态,测得体系压强升高.
| 物质 | CO2 | H2 | CH3OH | H2O |
| 起始投料/mol | 1 | 3 | 2 | 0 |
19.下列说法正确的是( )
| A. | Fe和Mg与0.1 mol•L-1的盐酸反应,反应速率相同 | |
| B. | 0.1 mol•L-1的盐酸与H2SO4分别与大小、形状相同的大理石反应,反应速率相同 | |
| C. | 催化剂能降低分予活化时所需能量,使单位体积内活化分子百分数大大增加 | |
| D. | 100Ml 2mol•L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变 |
6.下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值增大 | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)>c(HCO3-),且2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | 常温下0.4 mol•L-1 HB溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| D. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O═Na2CO3+2HClO |
3.下列有关离子检验的操作和实验结论正确的是( )
| A. | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液中一定含有NH4+ | |
| B. | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| C. | 向某溶液中加入氨水,产生白色沉淀,则该溶液中一定含有Mg2+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧,若火焰呈黄色,则证明该溶液中无K+离子 |



 .
. .
. 有多种同分异构体,其中含有1个醛基和2个羟基,且核磁共振氢谱显示为6组峰的芳香族化合物共有4种.
有多种同分异构体,其中含有1个醛基和2个羟基,且核磁共振氢谱显示为6组峰的芳香族化合物共有4种. 最合理的方案.
最合理的方案.