题目内容
13.下列说法一定正确的是( )| A. | 反应A(s)?2B(g)+C(g),当C的体积分数不变时,反应达到平衡状态 | |
| B. | 将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq) | |
| D. | 增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
分析 A、该反应中,A为固体,若只加入A开始反应,则C的体积分数始终不变,所以C的体积分数不变无法判断是否达到平衡状态;
B、与电源正极相连为电解池的阳极,阳极发生氧化反应,所以会加速钢闸门的腐蚀速度;
C.溶解度大的物质能转化为溶解度小的物质;
D.浓硫酸与铁反应不生成氢气;
解答 解:A、反应A(s)?2B(g)+C(g)中,A为固体,若加入的为初始反应物为B或者按照2:1加入B、C,反应过程中C的体积分数始终不变,所以C的体积分数不变时,无法判断是否达到平衡状态,故A错误;
B、将钢闸门与直流电源的正极相连,钢闸门为电解池的阳极,电解过程中阳极发生氧化反应,所以加快了钢闸门的腐蚀速度,故B错误;
C.溶解度大的物质能转化为溶解度小的物质,FeS溶解度大于HgS,所以离子反应方程式为FeS(s)+Hg2+(aq)=HgS(s)+Fe2+ (aq),故C正确;
D.浓硫酸具有强氧化性,常温下使铁发生钝化与铁反应不生成氢气,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断、物质的量浓度的计算、金属的腐蚀与防护等知识,题目难度中等,注意掌握化学平衡状态的特征及判断平衡状态的方法,掌握原电池工作原理,明确金属的防护方法.

练习册系列答案
相关题目
4.利用碳酸钠晶体(Na2CO3•10H2O)来配制1.0mol•L-1 Na2CO3溶液500mL,假如其他操作均准确无误,下列情况会引起所配溶液浓度偏高的是( )
| A. | 称取碳酸钠晶体53.0g | |
| B. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 | |
| C. | 定容时,俯视观察刻度线 | |
| D. | 定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线 |
8.下列关于有机物的叙述正确的是( )
| A. | 糖类、油脂和蛋白质均为高分子化合物 | |
| B. | 利用溴的四氯化碳溶液可除去甲烷中的乙烯 | |
| C. | 煤中含有苯、甲苯等,可通过煤的干馏制取 | |
| D. | 苯滴入溴水中振荡后水层接近无色,因为发生了加成反应 |
18.下列文字表述与反应方程式对应且正确的是( )
| A. | 实验室用溴水和苯在催化剂作用下制溴苯: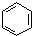 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$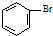 +HBr +HBr | |
| B. | 乙酸乙酯和H${\;}_{2}^{18}$O发生酸性水解反应:CH3COOC2H5+H-18OH $?_{△}^{酸}$CH3CO18OH+C2H5OH | |
| C. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2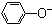 +CO2+H2O→ +CO2+H2O→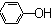 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$HCOONH4+2Ag↓+3NH3+H2O |
5.下列关于有机物的叙述正确的是( )
| A. | 1,2-二氯乙烷在NaOH水溶液中加热发生消去反应得到乙炔 | |
| B. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| C. | 除去电石和水反应产生的乙炔中杂质气体,可用稀硫酸洗气 | |
| D. | 由丙烯酸甲酯CH2=CHCOOCH3合成的聚合物为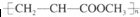 |
2. “C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
(1)向体积为 2L的密闭容器中充入1mol CO和2mol H2,在一定条件下发生如下反应:CO(g)+2H2(g)?CH3OH(g).经过t秒达到平衡,平衡时CO的转化率与温度、压强的关系如图所示.请回答:
①p1、T1℃时,从开始到平衡的过程中,用H2表示的平均反应速率为$\frac{0.5}{t}$mol•L-1•s-1
②图中压强p1< 压强p2.(填“>”、“<”或“=”)
(2)一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
①容器I中反应达到平衡所需时间比容器Ⅲ中的短(填“长”、“短”或“相等”)
②达到平衡时,容器I中的CH3OH的体积分数相等(填“大于”、“小于”或“相等”)容器Ⅱ中的CH3OH的体积分数.
③若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行(填“正反应”、“逆反应”或“不移动”).
(3)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).若反应在恒容绝热(不
与外界交换能量)条件下进行,按下表数据投料,反应达到平衡状态,测得体系压强升高.
则升高温度,该反应的平衡常数将减小(填“增大”“减小”或“不变”).
 “C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.(1)向体积为 2L的密闭容器中充入1mol CO和2mol H2,在一定条件下发生如下反应:CO(g)+2H2(g)?CH3OH(g).经过t秒达到平衡,平衡时CO的转化率与温度、压强的关系如图所示.请回答:
①p1、T1℃时,从开始到平衡的过程中,用H2表示的平均反应速率为$\frac{0.5}{t}$mol•L-1•s-1
②图中压强p1< 压强p2.(填“>”、“<”或“=”)
(2)一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生如下反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
| 容器 编号 | 温度(℃) | 起始的物质的量(mol) | 平衡的物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②达到平衡时,容器I中的CH3OH的体积分数相等(填“大于”、“小于”或“相等”)容器Ⅱ中的CH3OH的体积分数.
③若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行(填“正反应”、“逆反应”或“不移动”).
(3)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).若反应在恒容绝热(不
与外界交换能量)条件下进行,按下表数据投料,反应达到平衡状态,测得体系压强升高.
| 物质 | CO2 | H2 | CH3OH | H2O |
| 起始投料/mol | 1 | 3 | 2 | 0 |
3.下列有关离子检验的操作和实验结论正确的是( )
| A. | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液中一定含有NH4+ | |
| B. | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| C. | 向某溶液中加入氨水,产生白色沉淀,则该溶液中一定含有Mg2+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧,若火焰呈黄色,则证明该溶液中无K+离子 |