题目内容
12. 甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
Ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应Ⅰ中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
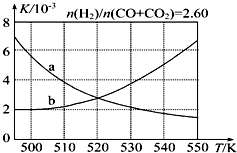
(2)反应Ⅰ的化学平衡常数K表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应Ⅰ正反应为放热反应,平衡常数随温度升高而减小.
分析 (1)反应热=反应物总键能-生成物总键能;根据盖斯定律:反应Ⅱ-反应Ⅰ=反应Ⅲ,反应热也进行相应的计算;
(2)化学平衡常数指可逆反应得到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值.
解答 解:(1)反应热=反应物总键能-生成物总键能,故△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;
根据盖斯定律:反应Ⅱ-反应Ⅰ=反应Ⅲ,故△H3=△H2-△H1=-58kJ.mol-1-(-99kJ.mol-1)=+41kJ.mol-1,
故答案为:-99;+41;
(2)反应①CO(g)+2H2(g)?CH3OH(g)的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;
反应Ⅰ正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,
故答案为:$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;a;反应Ⅰ正反应为放热反应,平衡常数随温度升高而减小.
点评 本题考查反应热有关计算、平衡常数及其影响因素等,侧重考查学生分析计算能力,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
2. I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
 I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )| A. | 反应I2(aq)+I-(aq)═I3- (aq)的△H>0 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 | |
| C. | 若反应进行到状态D时,一定有v正>v逆 | |
| D. | 状态A与状态B相比,状态A的c(I2) 小 |
3.已知在等温、等容条件下,有如下可逆反应:2A(g)+2B(g)?3C(g)+D(g).现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L.下列叙述正确的是( )
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的浓度相同 | |
| B. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| C. | 达到平衡时,Ⅰ途径的反应速率υ1等于Ⅱ途径的反应速率υ2 | |
| D. | 达到平衡时,Ⅰ途径混合气体的密度等于Ⅱ途径混合气体的密度 |
20.已知丙烷的燃烧热△H=-2 215kJ•mol-1,若一定量的丙烷完全燃烧后生成3.6g水,则放出的热量约为( )
| A. | 110 kJ | B. | 440 kJ | C. | 1100 kJ | D. | 2216 kJ |
7.PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)?PCl5(g),并于10min时达到平衡.有关数据如下:
下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol•L-1•min-1 | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件再达平衡时,c(PCl5)<0.2 mol•L-1 |
17.300mL 0.1mol•L-1的氯化钾溶液与100mL0.1mol•L-1 的氯化铁溶液的氯离子的物质的量的浓度之比是( )
| A. | 2:1 | B. | 1:1 | C. | 2:3 | D. | 1:3 |
4.一定条件下反应:R2O7n-+3S2-+14H+═2R3++3S+7H2O.则R2O7n-中R的化合价是( )
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
4.下列改变一定能说明化学平衡发生移动的是( )
| A. | 反应混合物中各物质的浓度的改变 | B. | 反应物转化率的改变 | ||
| C. | 正逆反应速率的改变 | D. | 反应容器中压强的改变 |
 A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素;B的一种单质在自然界中硬度最大;C、D的单质都是空气的主要成分;M位于元素周期表的第四周期第6纵行.
A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素;B的一种单质在自然界中硬度最大;C、D的单质都是空气的主要成分;M位于元素周期表的第四周期第6纵行.