题目内容
17.300mL 0.1mol•L-1的氯化钾溶液与100mL0.1mol•L-1 的氯化铁溶液的氯离子的物质的量的浓度之比是( )| A. | 2:1 | B. | 1:1 | C. | 2:3 | D. | 1:3 |
分析 根据溶液中氯离子的物质的量浓度=溶质的浓度×电解质电离出的氯离子个数,求出各溶液中Cl-的物质的量浓度,然后求比值.
解答 解:300mL 0.1mol/L KCl溶液中Cl-的物质的量浓度为0.1mol•L-1,100mL 0.1mol/L FeCl3溶液中Cl-的物质的量浓度为0.1mol•L-1×3=0.3mol•L-1,故300mL 0.1mol/L KCl溶液与100mL 0.1mol/L FeCl3溶液中Cl-物质的量浓度之比=0.1mol/L:0.3mol/L=1:3,
故选:D.
点评 本题考查了溶液中离子物质的量浓度的计算,比较基础,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
7.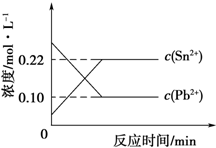 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 | |
| C. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H<0 |
5.下列实验事实能用平衡移动原理解释的是( )
| A. | 反应I2(g)+H2(g)?2H I(g) 达平衡后,压缩体积体系颜色变深 | |
| B. | H2O2中加入二氧化锰,生成氧气的速率加快 | |
| C. | 棕黄色的FeCl3溶液中加入铁粉颜色逐渐变为浅绿色 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
12.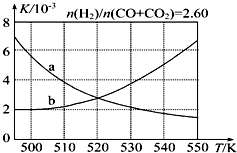 甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
Ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应Ⅰ中相关的化学键键能数据如下:
由此计算△H1=-99kJ•mol-1;已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
(2)反应Ⅰ的化学平衡常数K表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应Ⅰ正反应为放热反应,平衡常数随温度升高而减小.
 甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
Ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应Ⅰ中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
(2)反应Ⅰ的化学平衡常数K表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应Ⅰ正反应为放热反应,平衡常数随温度升高而减小.
2.下列反应能用离子方程式H++OH-═H2O来表示的是( )
| A. | H2SO4+Ba(OH)2═BaSO4↓+2H2O | B. | 2HCl+Ba(OH)2═BaCl2+2H2O | ||
| C. | H2SO4+Cu(OH)2═CuSO4+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
9.下列物质既是电解质又能导电的是( )
| A. | NaCl晶体 | B. | 液态HCl | C. | 熔融的KNO3 | D. | Na2SO4溶液 |
6.某溶液既能溶解A12O3,又能H2SiO3,在该溶液中可以大量共存的离子是( )
| A. | Na+、HCO3-、Cl-、SO42- | B. | Na+、Fe2+、Cl-、SO42- | ||
| C. | Na+、SO42-、Cl-、ClO- | D. | NH4+、Na+、NO3-、Cl- |
9.某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3ˉ、NO3ˉ、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).
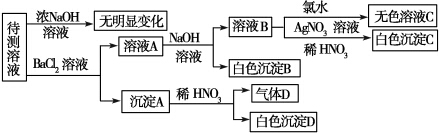
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
(2)待测溶液中是否有SO42-、SO32-中的一种或两种.若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O,形成沉淀B时反应的离子方程式为HCO3-+Ba2++OH-═BaCO3↓+H2O.
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.

请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | ||
| 化学式或 离子符号 | ||||
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.
 二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.