题目内容
1. A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素;B的一种单质在自然界中硬度最大;C、D的单质都是空气的主要成分;M位于元素周期表的第四周期第6纵行.
A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素;B的一种单质在自然界中硬度最大;C、D的单质都是空气的主要成分;M位于元素周期表的第四周期第6纵行.回答下列问题:
(1)元素M的基态原子电子排布式为1s22s22p63s23p63d54s1.
(2)B的10电子氢化物中,中心原子的杂化轨道类型为sp3,C的10电子氢化物分子的立体构型为三角锥形该氢化物易溶于水的原因是氨气分子与水分子之间形成氢键,氨气分子、水分子均为极性分子,相似相溶.
(3)C、D的第一电离能的大小为N>O(用元素符号表示).
(4)由A、B、C形成的ABC分子中,含有2个σ键和2个π键.
(5)化合物MO2Cl2在有机合成中可作氧化剂,能写许多有机物反应.
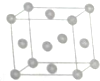
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有2种,其中一种金属的晶胞结构如图所示,该晶胞结构中金属原子的配位数为12.
②常温下,MO2Cl2为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是非极性(填“极性”或“非极性”)分子.
分析 A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素,则A为H元素;B的一种单质在自然界中硬度最大,则B为碳元素;C、D的单质都是空气的主要成分,则C为N元素、D为O元素;
M位于元素周期表的第四周期第6纵行,则M为Cr元素.
(1)M位于元素周期表的第四周期第6纵行,即处于第四周期VIB族,根据能量最低原理书写;
(2)B的10电子氢化物为CH4,C原子形成4个C-H价,杂化轨道数目为4;
C的10电子氢化物分子为NH3,为三角锥形结构,氨气分子与水分子之间形成氢键,氨气分子、水分子均为极性分子,相似相溶;
(3)N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(4)由A、B、C形成的ABC分子为HCN,结构式为H-C≡N,单键为σ键,三键含有1个σ键、2个π键;
(5)①与Cr同周期的所有元素的基态原子中最外层电子数与Cr原子相同的元素有K、Cu,其中一种金属的晶胞结构为面心立方最密堆积,以顶点原子研究,与之最近的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用;
②常温下,CrO2Cl2为深红色液体,能与CCl4、CS2等互溶,根据相似相溶原理可知,CrO2Cl2是非极性分子.
解答 解:A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素,则A为H元素;B的一种单质在自然界中硬度最大,则B为碳元素;C、D的单质都是空气的主要成分,则C为N元素、D为O元素;
M位于元素周期表的第四周期第6纵行,则M为Cr元素.
(1)M位于元素周期表的第四周期第6纵行,即处于第四周期VIB族,根据能量最低原理,元素M的基态原子电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(2)B的10电子氢化物为CH4,C原子形成4个C-H价,杂化轨道数目为4,C原子杂化方式为sp3杂化;
C的10电子氢化物分子为NH3,为三角锥形结构,氨气分子与水分子之间形成氢键,氨气分子、水分子均为极性分子,相似相溶,故氨气易溶于水,
故答案为:sp3;三角锥形;氨气分子与水分子之间形成氢键,氨气分子、水分子均为极性分子,相似相溶;
(3)N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O,
故答案为:N;O;
(4)由A、B、C形成的ABC分子为HCN,结构式为H-C≡N,单键为σ键,三键含有1个σ键、2个π键,HCN分子含有2个σ键、2个π键,
故答案为:2;2;
(5)①与Cr同周期的所有元素的基态原子中最外层电子数与Cr原子相同的元素有K、Cu,其中一种金属的晶胞结构为面心立方最密堆积,以顶点原子研究,与之最近的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,金属原子配位数为$\frac{3×8}{2}$=12,
故答案为:2;12;
②常温下,CrO2Cl2为深红色液体,能与CCl4、CS2等互溶,根据相似相溶原理可知,CrO2Cl2是非极性分子,故答案为:非极性.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、化学键、氢键、杂化方式判断、分子结构与性质、晶胞结构等,注意对基础知识的理解掌握.

(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.
某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/(mg•L-1) | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
②工业上常用饱和食盐水为原料制备氯气,反应的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+Cl2↑+H2↑.
③电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
a.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O.
b.淡水的出口为a、b、c中的b出口.
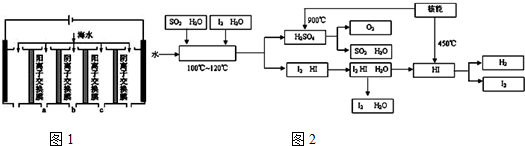
(2)科学家预测“氢能”将是未来最理想的新能源.
①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 KJ/mol.
②如图2是某国正在研究中的一种流程(硫-碘热循环法制氢气),其中用了过量的碘.如图2方框中发生的化学反应方程式:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$2HI+H2SO4.
 甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
Ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应Ⅰ中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
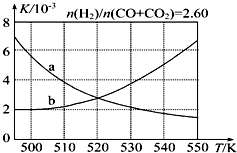
(2)反应Ⅰ的化学平衡常数K表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应Ⅰ正反应为放热反应,平衡常数随温度升高而减小.
| A. | NaCl晶体 | B. | 液态HCl | C. | 熔融的KNO3 | D. | Na2SO4溶液 |
| A. | Na+、HCO3-、Cl-、SO42- | B. | Na+、Fe2+、Cl-、SO42- | ||
| C. | Na+、SO42-、Cl-、ClO- | D. | NH4+、Na+、NO3-、Cl- |
| A. | 150mL 0.5 mol/L MgCl2溶液 | B. | 100mL 1.0mol/L HCl溶液 | ||
| C. | 250mL 1.5mol/L NaCl溶液 | D. | 300 mL 0.25mol/L CaCl2溶液 |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题: