题目内容
4.下列改变一定能说明化学平衡发生移动的是( )| A. | 反应混合物中各物质的浓度的改变 | B. | 反应物转化率的改变 | ||
| C. | 正逆反应速率的改变 | D. | 反应容器中压强的改变 |
分析 分析条件的改变会导致哪些量的变化,是否引起正逆反应速率变化,如果正逆反应速率相同,平衡一定不移动.
如果正逆反应速率改变,且正逆反应速率不相同,则平衡一定移动:
(1)改变程度相同[V(正)=V(逆)],平衡不移动;
(2)改变程度不相同[V(正)≠V(逆)],平衡移动,
A.浓度改变,化学平衡不一定发生移动,对于反应前后气体体积不变的反应缩小体积,压强增大平衡不变;
B.反应物转化率不变是化学平衡的标志;
C.正逆反应速率改变,化学平衡不一定发生变化,如催化剂加快反应速率,平衡不变;
D.对于反应前后气体体积不变的反应,在恒温恒容条件下改变压强,平衡不动;
解答 解:A.对于反应前后气体体积不变的反应缩小体积,压强增大平衡不变,如H2(g)+I2(g)=2HI(g),减小体积浓度增大,平衡不变,浓度改变,化学平衡不一定发生移动,故A错误;
B.反应物转化率不变是化学平衡的标志,当反应物转化率改变,说明化学平衡发生移动,反应物转化率改变一定能说明化学平衡发生移动,故B正确;
C.反应中加入催化剂加快反应速率,化学平衡不变,所以正逆反应速率改变,化学平衡不一定发生变化,故C错误;
D.对于反应前后气体体积不变的反应,如H2(g)+I2(g)=2HI(g),在恒温恒容条件下改变压强,速率改变但平衡不动,反应容器中压强的改变平衡不一定改变,故D错误;
故选B.
点评 本题考查了化学平衡影响因素,平衡移动的条件判断,不要把V(正)增大与平衡向正反应方向移动等同起来,只有V(正)>V(逆)时,平衡向正反应方向移动,压强、速率改变平衡不一定发生移动,理解平衡移动原理是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.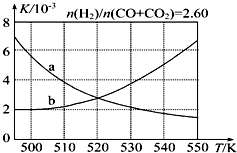 甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
Ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应Ⅰ中相关的化学键键能数据如下:
由此计算△H1=-99kJ•mol-1;已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
(2)反应Ⅰ的化学平衡常数K表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应Ⅰ正反应为放热反应,平衡常数随温度升高而减小.
 甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
Ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应Ⅰ中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
(2)反应Ⅰ的化学平衡常数K表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应Ⅰ正反应为放热反应,平衡常数随温度升高而减小.
13.下列溶液中,跟150mL0.5mol/LNaCl溶液所含的氯离子物质的量浓度相同的是( )
| A. | 150mL 0.5 mol/L MgCl2溶液 | B. | 100mL 1.0mol/L HCl溶液 | ||
| C. | 250mL 1.5mol/L NaCl溶液 | D. | 300 mL 0.25mol/L CaCl2溶液 |
19.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA | |
| B. | 常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA | |
| C. | 室温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
9.某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3ˉ、NO3ˉ、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).
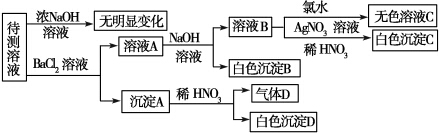
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
(2)待测溶液中是否有SO42-、SO32-中的一种或两种.若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O,形成沉淀B时反应的离子方程式为HCO3-+Ba2++OH-═BaCO3↓+H2O.
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.

请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | ||
| 化学式或 离子符号 | ||||
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.
14.将铁片投入下列溶液中,溶液质量变大的是( )
| A. | 硝酸银 | B. | 硫酸铁 | C. | 硫酸铜 | D. | 氯化镁 |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题: