题目内容
3.已知在等温、等容条件下,有如下可逆反应:2A(g)+2B(g)?3C(g)+D(g).现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L.下列叙述正确的是( )| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的浓度相同 | |
| B. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| C. | 达到平衡时,Ⅰ途径的反应速率υ1等于Ⅱ途径的反应速率υ2 | |
| D. | 达到平衡时,Ⅰ途径混合气体的密度等于Ⅱ途径混合气体的密度 |
分析 由反应2A(g)+2B(g)?3C(g)+D(g)可知,反应前后气体的化学计量数相等,压强对平衡移动没有影响,当满足Ⅱ所加物质完全转化为A、B时,为4molA和4molB,与Ⅰ物质的量比值相等,相当于增大压强,改变压强不改变化学平衡,则与Ⅰ达到相同平衡状态.据此进行判断,
A.上述分析可知Ⅰ、Ⅱ两途径最终达到相同平衡状态,起始量不同,当满足Ⅱ所加物质完全转化为A、B时,为4molA和4molB,与Ⅰ物质的量比值相等,平衡状态下各物质的浓度不相同;
B.上述分析可知Ⅰ、Ⅱ两途径最终达到相同平衡状态,各组分含量保持不变;
C.当满足Ⅱ所加物质完全转化为A、B时,为4molA和4molB,与Ⅰ物质的量比值相等,相当于增大压强,反应速率大,压强改变不影响化学平衡,最后达到相同平衡状态;
D.由于容器体积相等,Ⅱ气体质量是Ⅰ气体质量的2倍,结合密度ρ=$\frac{m}{V}$分析.
解答 解:反应2A(g)+2B(g)?C(g)+3D(g)可知,反应前后气体的化学计量数相等,压强对平衡移动没有影响,当满足Ⅱ所加物质完全转化为A、B时,与Ⅰ物质的量比值相等,
A、Ⅱ所加物质完全转化为A、B时,可生成4molA、4molB,与Ⅰ物质的量比值相等,相当于增大压强,改变压强不改变化学平衡,与Ⅰ物质的量不相等,平衡状态相同,所以Ⅰ、Ⅱ的浓度不同,故A错误;
B、Ⅰ、Ⅱ两途径最终达到相同平衡状态,体系内混合气体的百分组成相同,故B正确;
C、Ⅱ途径达到平衡时浓度大,压强大,反应速率应较大,达到平衡时,Ⅰ途径的反应速率υ1小于Ⅱ途径的反应速率υ2 ,故C错误;
D、Ⅰ、Ⅱ为等效平衡状态,体系内混合气体的百分组成相同,混合气体平均相对分子质量相同,由于容器体积相等,Ⅱ气体质量是Ⅰ气体质量的2倍,则达到平衡时,途径Ⅰ的气体密度为途径Ⅱ密度的$\frac{1}{2}$,故D错误;
故选B.
点评 本题考查等效平衡问题,题目难度中等,注意等效平衡有2种情况:①化学反应前后气体的化学计量数之和不等的反应必须满足物质的量完全相等,②反应前后气体的化学计量数相等,满足物质的量之比相等.

| A. | 配制FeSO4溶液时,需加入少量铁粉和稀盐酸,既防止氧化又抑制水解 | |
| B. | 向纯水中加入盐酸或降温都能使电离平衡逆向移动,但水的离子积不变 | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.
某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/(mg•L-1) | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
②工业上常用饱和食盐水为原料制备氯气,反应的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+Cl2↑+H2↑.
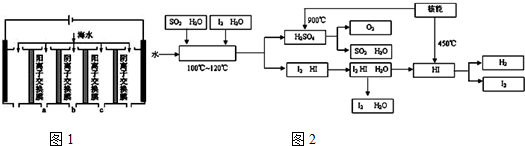
③电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
a.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O.
b.淡水的出口为a、b、c中的b出口.
(2)科学家预测“氢能”将是未来最理想的新能源.
①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 KJ/mol.
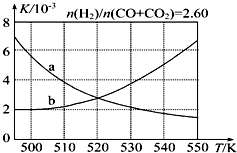
②如图2是某国正在研究中的一种流程(硫-碘热循环法制氢气),其中用了过量的碘.如图2方框中发生的化学反应方程式:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$2HI+H2SO4.
| A. | X>Z>Y>M | B. | X>M>Z>Y | C. | M>Y>Z>X | D. | M>X>Z>Y |
 甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:Ⅰ.CO(g)+2H2(g)?CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
Ⅲ.CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应Ⅰ中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
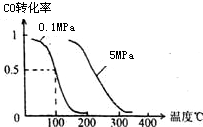
(2)反应Ⅰ的化学平衡常数K表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应Ⅰ正反应为放热反应,平衡常数随温度升高而减小.
| A. | 150mL 0.5 mol/L MgCl2溶液 | B. | 100mL 1.0mol/L HCl溶液 | ||
| C. | 250mL 1.5mol/L NaCl溶液 | D. | 300 mL 0.25mol/L CaCl2溶液 |
 (1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
(1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0 二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.