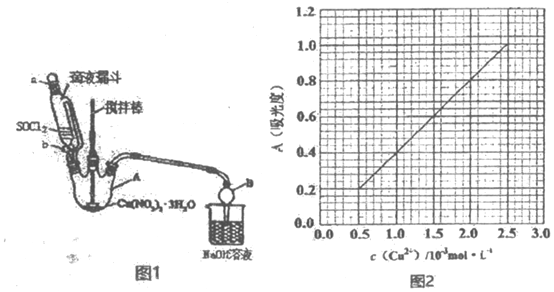
题目内容
15.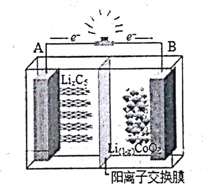 如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )
如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )| A. | 放电时,负极反应LiCoO2-xe-═Li(1-x)CoO2+Li+ | |
| B. | 充电时,A极发生氧化反应 | |
| C. | 充电时,Li+穿过隔离膜向B极移动 | |
| D. | 当B极失去xmol电子,电池消1molLiCoO2 |
分析 A.放电时该装置为原电池,负极上失电子发生氧化反应;
B.充电时该装置为电解池,B为电解池阳极,阴极上发生氧化反应;
C.充电时该装置为电解池,阳离子向阴极移动;
D.根据LiCoO2和转移电子之间的关系式计算.
解答 解:A.放电时该装置为原电池,根据电子流向知,A为原电池负极,负极上电极反应式为:LixC6-xe-=xLi++6C,故A错误;
B.充电时该装置为电解池,根据电子流向知,B为电解池阳极,阳极上得电子发生氧化反应,故B错误;
C.充电时该装置为电解池,阳离子Li+向阴极A移动,故C错误;
D.当B极失去xmol电子时,该装置为电解池,B为电解池阳极,电极反应式为LiCoO2-xe-=Li(1-x)CoO2+xLi+,所以当B极失去xmol电子,电池消1molLiCoO2,故D正确;
故选D.
点评 本题考查了原电池和电解池原理,明确充放电时各个电极上发生的反应及根据电子流向判断电极是解本题关键,难点是电极反应式的书写,难度较大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
3.根据下列实验操作和现象得出的结论不合理的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将乙醇加入酸性重铬酸钾(K2Cr2O7)溶液中 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| B | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
| C | 将光亮的镁条放入NH4Cl溶液中 | 有大量气泡产生 | 反应生成H2和NH3 |
| D | 将NaAlO2溶液加入NaHCO3溶液中 | 有白色沉淀生成 | AlO2-结合H+的能力比HCO3-强 |
| A. | A | B. | B | C. | C | D. | D |
10.2016年是门捷列夫诞生辰182周年,门捷列夫在化学史上的贡献是( )
| A. | 提出了元素周期律 | B. | 提出了杂化轨道理论 | ||
| C. | 发现了电子 | D. | 发现了能量最低原理 |
20.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.下图是工业上用制作印刷电路银板的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:(已知:滤液①和滤液②中溶质相同)

根据以上信息回答下列问题:
(1)写出生产过程中加入的试剂的名称:X铁粉,Y稀盐酸.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
析出CuCl晶体最佳pH为2,当pH较大时CuCl产率变低的原因是pH较大时,Cu2+水解程度增大,反应生成CuCl减少,产率减小.
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.
已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.三次平行实验结果如下
则样品中CuCl的纯度为95.5%(结果保留三位有效数字).

根据以上信息回答下列问题:
(1)写出生产过程中加入的试剂的名称:X铁粉,Y稀盐酸.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.
已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.三次平行实验结果如下
| 平行实验次数 | 1 | 2 | 3 | 4 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 25.35 | 24.05 | 23.95 | 24.00 |
11.下列化合物的用途叙述正确的是( )
| A. | 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2 | |
| B. | 水玻璃可用作防火剂或防腐剂 | |
| C. | 高锰酸钾溶液、SO2、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| D. | SO2可用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
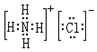 ,其中存在的化学键类型为离子键和共价键.
,其中存在的化学键类型为离子键和共价键.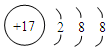 ;元素D最高价氧化物的水化物的化学式为H3PO4或HPO3.
;元素D最高价氧化物的水化物的化学式为H3PO4或HPO3.