题目内容
10.2016年是门捷列夫诞生辰182周年,门捷列夫在化学史上的贡献是( )| A. | 提出了元素周期律 | B. | 提出了杂化轨道理论 | ||
| C. | 发现了电子 | D. | 发现了能量最低原理 |
分析 1868年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一.
解答 解:A.俄国的门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出元素周期表,故A正确;
B.杂化轨道理论是1931年由莱纳斯•鲍林等人在价键理论的基础上提出的.杂化轨道理论在成键能力、分子的空间构型等方面丰富和发展了现代价键理论,故B错误;
C.1897年汤姆生发现了电子,使人们认识到:原子是由原子核和核外电子组成的.从而确立了“原子不是组成物质的最小微粒”的观点,故C错误;
D.能量最低原理是核外电子排布时,尽先占据能量最低的轨道,由狄拉克.狄拉克于1930年提出,故D错误;
故选A.
点评 本题考查化学史,是常识性问题,对于化学上重大发现、著名理论要加强记忆,这也是考试内容之一,题目难度不大.

练习册系列答案
相关题目
1.下列有关说法正确的是( )
| A. | 12753I和13153I是质子数相同的同种核素 | |
| B. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 | |
| C. | 实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| D. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
18.孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤.常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的一组离子正确的是( )
| A. | 加入过量氨水:Fe3+、NH4+、SO42-、OH- | |
| B. | 加入过量NaClO溶液:Fe2+、H+、Cu2+、SO42- | |
| C. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| D. | 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3- |
5.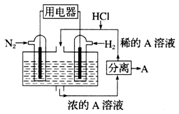 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )| A. | A为NH4Cl | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 该电池外电路电子从通入N2的电极流向通入H2的电极 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH+ |
15.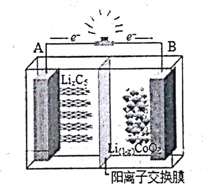 如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )
如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )
 如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )
如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )| A. | 放电时,负极反应LiCoO2-xe-═Li(1-x)CoO2+Li+ | |
| B. | 充电时,A极发生氧化反应 | |
| C. | 充电时,Li+穿过隔离膜向B极移动 | |
| D. | 当B极失去xmol电子,电池消1molLiCoO2 |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1molO2,转移电子数目为2NA | |
| C. | 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液Na+数目相等 | |
| D. | 常温常压下,4.6g乙醇中含有极性共价键的数目为0.8NA |
6. CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )
CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )
 CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )
CO2经催化加氢可合成乙烯:2CO2 (g)+6H2(g)?C2H4(g)+4H2O(g).0.1MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图.下列叙述不正确的是( )| A. | 该反应的△H<O | |
| B. | 曲线b代表H2O | |
| C. | N点和M点所处状态的c(H2)不一样 | |
| D. | 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大 |
1.用NA表示阿伏德罗常数,下列叙述错误的是( )
| A. | 28gN2所含原子数为NA | B. | 0.5molH2O所含原子数为1.5NA | ||
| C. | 1molH2O含有的水分子数目为NA | D. | 0.5NACl2分子的物质的量是0.5mol |
 铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是:
铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是: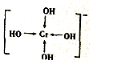 .
.